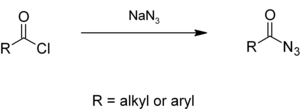அசைடு
அசைடு (Azide) என்பது N3 − என்ற வாய்ப்பாட்டால் குறிப்பிடப்படும் ஒர் எதிர்மின் அயனியாகும். ஐதரசோயிக் அமிலத்தினுடைய இணை காரமாக (HN3) இவ்வயனி கருதப்படுகிறது. நேர்கோட்டு அமைப்பு அயனியான இது CO2 மற்றும் N2O ஆகியனவற்றை ஒத்த எலக்ட்ரான் எண்ணிக்கை கொண்டிருக்கிறது. பல்வேறு வகையான ஒத்திசைவு கட்டமைப்புகளை அசைடு பெற்றிருப்பதாக இணைதிறன் பிணைப்புக் கொள்கை விவரிக்கிறது. இக்கட்டமைப்புகளுள் முக்கியமானது. N−=N+=N−.என்ற கட்டமைப்பாகும். கரிம வேதியியலில் ஒரு வேதி வினைக்குழுவாகவும் அசைடு RN3 கருதப்படுகிறது[1] . காற்றுப் பைகளில் உந்து பொருளாகப் பயன்படுவது அசைடுகளின் ஓங்கியப் பயனாகும்.
தயாரிப்பு[தொகு]
கனிம வேதியியல் அசைடுகள்[தொகு]
தொழிற்சாலைகளில் நைட்ரசு ஆக்சைடுடன் (N2O) திரவ அமோனியாவில் கரைந்த சோடியம் அமைடைச் சேர்த்து வினைபுரியச் செய்து சோடியம் அசைடு தயாரிக்கிறார்கள்:[2]
- N2O + 2 NaNH2 → NaN3 + NaOH + NH3
பல்வேறு கனிம வேதியியல் அசைடுகளையும் சோடியம் அசைடை நேரிடையாகவோ அல்லது மறைமுகமாகவோ பயன்படுத்தி தயாரிக்க முடியும். உதாரணமாக ஈய அசைடு, தூண்டு வெடியாகப் பயன்படும் இதை ஈய நைட்ரேட்டு மற்றும் சோடியம் அசைடைப் பயன்படுத்தி இடம்பெயர்தல் வினையின் மூலமாகத் தயாரிக்கலாம். திரவ அமோனியாவில் கரைந்த[3] வெள்ளி அசைடுடன் நேரடியாக ஈயத்தை வினைபுரியச் செய்து மாற்று வழியிலும் ஈய அசைடைத் தயாரிக்கலாம். சிலவகை அசைடுகளை ஐதரசோயிக் அமிலத்துடன் கார்பனேட்டு உப்புகளை வினைபுரியச் செய்து தயாரிக்கிறார்கள்.
கரிம வேதியியல் அசைடுகள்[தொகு]
அசைடு தயாரிப்பின் முதன்மையான மூலாதாரமாக சோடியம் அசைடு விளங்குகிறது. போலி உப்பீனிச் சேர்மமான சோடியம் அசைடு பொதுவாக விடுபடும் குழுக்களை இடப்பெயர்ச்சி ( உதாரணம்; Br, I) செய்து அசைடோ சேர்மங்களைக் கொடுக்கிறது. இதேபோல அரைல் அசைடுகளும் பொருத்தமான ஈரசோனியம் உப்புகளை சோடியம் அசைடு அல்லது மும்மெத்தில்சிலில் அசைடுடன் இடப்பெயர்ச்சி செய்து தயாரிக்கப்படுகின்றன. குளோரைடு அயனிகளுடன் அரோமாட்டிக் அணுக்கரு விருப்ப பதிலீட்டுவினை மூலமாக அசைடு தயாரிக்கப்படும் சாத்தியங்களும் உள்ளன. அனிலீன்கள் மற்றும் அரோமாட்டிக் ஐதரசீன்கள், ஈரசோனிய ஆக்கம் வினையில் ஈடுபட்டு ஆல்கைல் அமீன்களும் ஐதரசீன்களும் செய்த பணியை இவை மேற்கொள்கின்றன[1]
பொருத்தமாகச் செயல்படக்கூடிய அலிஃபாட்டிக் சேர்மங்கள் அணுக்கரு விருப்பப் பதிலீட்டு வினைகளில் சோடியம் அசைடுடன் பங்கேற்கின்றன. அலிஃபாட்டிக் ஆல்ககால்கள் மிட்சனோபு வினையில் ஐதரசோயிக் அமிலத்தைப் பயன்படுத்துவதன் வழியாக அசைடுகளைக் கொடுக்கின்றன.[1] சோடியம் நைட்ரைட்டுடன் ஐதரசீன்கள் வினைபுரிவதாலும் அசைடுகள் உருவாகின்றன:[4]
- PhNHNH2 → PhN3
ஆல்கைல் அல்லது அரைல் அசைல் குளோரைடுகள் நீர்க் கரைசலில் உள்ள சோடியம் அசைடுடன் வினைபுரிந்து அசைல் அசைடுகளைத் தருகின்றன.[5][6] இவை கர்டியசு மறுசீராக்கல் வினையின் வழியாக சமசயனேட்டுகளைக் கொடுக்கின்றன.
முப்புளோரோமீத்தேன்சல்பனைல் அசைடு மற்றும் இமிடசோல் -1- சல்பனைல் அசைடு போன்ற அசோ மாற்றச் சேர்மங்களையும் சோடியம் அசைடில் இருந்தே தயாரிக்க முடியும். அவை அமீன்களுடன் வினைபுரிந்து பொருத்தமான அசைடுகளைக் கொடுக்கின்றன.
- RNH2 → RN3
தத் – வோர்மால் வினை[தொகு]
அசைடுகள் தயாரிப்பதற்கான ஒரு உன்னதமான முறையாக தத் - வோர்மால் வினை கருதப்படுகிறது.[7] இவ்வினையில் ஈரசோனியம் உப்புகள் முதலில் சல்போனமைடுடன் வினைபுரிந்து ஈரசோவமினோசல்பைனேட்டைக் கொடுக்கின்றன. பின்னர் இவை நீராற்பகுப்பின் மூலம் அசைடு மற்றும் ஒரு சல்பைனிக் அமிலத்தைத் தருகின்றன.[8]
வினைகள்[தொகு]
கனிம வேதியல் அசைடுகள்[தொகு]
அசைடு உப்புகள் வெப்பப்படுத்தும் போது சிதைவடைந்து நைட்ரசன் வாயுவை வெளியிடுகின்றன. கார உலோக அசைடுகளின் சிதைவடைதல் வெப்பம் இங்குத் தரப்படுகிறது: NaN3 (275 °செ), KN3(355 °செ), RbN3 (395 °செ),மற்றும் CsN3 (390 °செ) இம்முறையைப் பயன்படுத்தி மீத்தூய கார உலோகங்கள் தயாரிக்கப்படுகின்றன[9]
அசைடு உப்புகளை வலிமையான அமிலங்கள் முன்னிலையில் புரோட்டானேற்றம் செய்யும் போது அவை நச்சுத்தன்மையுள்ள ஐதரசோயிக் அமிலத்தைத் தருகின்றன.
- H+ + N3− → HN3
கன உலோகங்கள் அல்லது கன உலோகச் சேர்மங்களுடன் அசைடு உப்புகள் வினைபுரிந்து அவற்றுடன் தொடர்புடைய பொருத்தமான அசைடுகளைத் தருகின்றன. இவை சோடியம் அசைடுகளைவிட அதிர்ச்சிக்கு உணர்திறன் மிக்கவைகளாக உள்ளன. அவை அமிலமாதலுக்கு உட்பட்ட சோடியம் நைட்ரைட்டுடன் சேர்ந்து சிதைவடைகின்றன. எஞ்சியிருக்கும் அசைடுகளை வெளியேற்றுவதற்கு முன்னர் அவற்றை அழிக்க இம்முறையை மேற்கொள்ள வேண்டும்.[10]
- 2 NaN3 + 2 HNO2 → 3 N2 + 2 NO + 2 NaOH
குளோரின், புரோமின் மற்றும் அயோடின் போன்ற பல கனிம சகபிணைப்பு அசைடுகள் அறியப்படுகின்றன.[11]
அசைடு எதிர்மின் அயனி ஒரு மின்னணு மிகு பொருளாகச் செயல்படுகிறது. அலிஃபாட்டிக் மற்றும் அரோமாட்டிக் நிலைகள் இரண்டிலும் இவை அணுக்கரு விருப்ப பதிலீட்டு வினைகளில் பங்கேற்கின்றன. ஈபாக்சைடுகளுடன் வினைபுரிந்து புதிய வளையங்களைத் திறக்கின்றன. 1,4 நிறைவுறா கார்பனைல்களுடன் இணைக்கூடல் வினையிலும் இவை பங்கேற்கின்றன.[1]
உலோக நைட்ரிடோ கூட்டுச் சேர்மங்கள் தயாரிப்பிலும் அசைடுகள் முன்னோடிகளாகத் திகழ்கின்றன. இவ்வாறு தயாரிக்கப்பட்ட கூட்டுச்சேர்மங்கள் வழக்கத்திற்கு மாறான ஆக்சிசனேற்ற நிலைகளில் உலோகக் கூட்டுச் சேர்மங்களை உருவாக்கி நைட்ரசன் வாயுவை வெளிவிடுகின்றன.
கரிம வேதியியல் அசைடுகள்[தொகு]
கரிம வேதியியல் அசைடுகள் உபயோகமுள்ள பல்வேறு கரிம வினைகளில் பங்கேற்கின்றன. விளிம்புநிலை நைட்ரசன் பகுதியாக மின்னணு மிகுபொருளாகச் செயல்படுகிறது. ஈரணு நைட்ரசன்களை அசைடுகள் எளிதாக வெளித்தள்ளுகின்றன. சிடாடிங்கர் வினை அல்லது கர்டியசு மறுசீராக்கல் வினை அல்லது γ- இமினோ-β-இனாமினோ எசுத்தர்கள் தொகுப்பு வினை போன்ற வினைகளில் அசைடுகளின் நைட்ரசனை வெளித்தள்ளும் போக்கு வெளிப்படுகிறது.[12][13]
சிடாடிங்கர் வினையில் அசைடுகள் ஐதரசன் நீக்க வினையினால்[14] அல்லது முப்பீனைல்பாசுப்பைன் போன்ற பாசுப்பைன்களால் அமீன்களாக ஒடுக்கப்படுகின்றன. இவ்வினை 1,1,1- மூன்று (அமினோமெத்தில்) ஈத்தேன் தொகுப்பு வினைக்கான மூலமாக விவரிக்கப்படுகிறது.
- 3 H2 + CH3C(CH2N3)3 → CH3C(CH2NH2)3 + 3 N2
அசைடு-ஆல்கைன் இயூசிகென் வளையக்கூட்டு வினையில் கரிம அசைடுகள் 1,3 இருமுனைவுகளில். ஆல்கைன்களுடன் வினைபுரிந்து 1,2,3 மூவசோல்களைக் கொடுக்கின்றன. இவ்வினை வேதித் தொகுப்பின் சொடுக்கு சொடுக்கு வேதியியலில் மிகவும் பிரபல்யமானது ஆகும்.
டோசில் அசைடு என்பது மற்றொரு வழக்கமான அசைடு ஆகும். இங்கு இவ்வினையில் நார்போர்னாடையீனுடன் டோசில் அசைடு நைட்ரசன் உட்புகுத்தும் வினையில் பங்கேற்கிறது.:[15]
பயன்கள்[தொகு]
சுமார் 250 டன்கள் அளவுள்ள அசைடு சேர்மங்கள் ஆண்டுதோறும் உற்பத்தி செய்யப்படுகின்றன. இதில் சோடியம் அசைடு ஒரு மிகமுக்கியமான உற்பத்திப் பொருளாகும்.[16]
தூண்டு வெடி மற்றும் உந்துபொருள்[தொகு]
தானுந்து காற்றுப் பைகளில் உந்து பொருளாக சோடியம் அசைடு பயன்படுகிறது. சூடுபடுத்தும்போது இது சிதைவடைந்து நைட்ரசன் வாயுவைக் கொடுக்கிறது. இவ்வாயு காற்றுப்பைகளை விரிவடையச் செய்கிறது.:[16]
- 2 NaN3 → 2 Na + 3 N2
ஈய அசைடு, Pb(N3)2 போன்ற கனவுலோக உப்புகள் அதிர்ச்சி உணர்திறன் மிக்க தூண்டு வெடிகளாக உள்ளன. இவை சிதைவடைந்து தொடர்புடைய தனிமமாகவும் நைட்ரசனாகவும் சிதைவடைகின்றன. உதாரணம்::[17]
- Pb(N3)2 → Pb + 3 N2
இவ்வாறே வெள்ளி மற்றும் பேரியம் உப்புகள் பயன்படுத்தப்படுகின்றன. சில கரிம அசைடுகள், 2-இருமெத்திலமினோ எத்திலசைடு போன்றவை ராக்கெட்டுகளில் உந்துபொருளாகப் பயன்படுகின்றன.
பிற பயன்கள்[தொகு]
அசைடுகளுடன் இணைந்துள்ள தீங்கு விளைவுகளின் காரணமாக சில அசைடுகள் மட்டுமே வணிக முக்கியத்துவம் கொண்டுள்ளன. மேலும் சில அசைடுகள் ஆய்வாளர்களின் ஆய்வுக்குப் பயன்படுகின்றன. குறிப்பாக குறைந்த மூலக்கூறு எடையுள்ள அசைடுகள் தவிர்க்கப்படுகின்றன. ஆய்வகங்களில் அமீன்கள் தயாரிப்பதற்கு முன்னோடிகளாகவும் இவை விளங்குகின்றன. சிடாடிங்கர் வினை அல்லது கர்டியசு மறுசீராக்கல் வினை மற்றும் சொடுக்கு வேதியியல் பிரிவுகளில் அசைடுகள் முக்கியத்துவம் பெற்று சேர்மான வேதியலுக்கு நம்பத்தகுந்த பங்களிப்பை அளிக்கின்றன. நுண்ணுயிரி எதிர்ப்பு சிடோவுடின் மருந்தில் அசைடோ தொகுதி இடம்பெற்றுள்ளது. உயிர் செங்குத்து இரசாயண அறிவிப்பாளராக சில அசைடுகள் பயன்தருகின்றன.
பாதுகாப்பு[தொகு]
- வெடிவினைக் குழு மற்றும் நச்சாக அசைடுகள் செயல்படுகின்றன.
- சோடியம் அசைடு ஒரு நச்சாகும் . இதனுடைய எலிகளுக்கான உயிர்போக்கும் அளவுகோல் மதிப்பு LD50 வாய்வழி (எலி) == 27 மி.கி/கி.கி ஆகும். தோலால் இதை உட்கிரகித்துக் கொள்ள முடியும். 275 0 செல்சியசு வெப்பநிலையில் இது வெடித்துச் சிதைகிறது. மேலும், CS2, புரோமின், நைட்ரிக் அமிலம் இருமெத்தில் சல்பேட்டு மற்றும் தாமிரம் , ஈயம் போன்றவற்றுடன் தீவிரமாக வெடிக்கும் இயல்புடன் வினைபுரிகிறது. தண்ணீர் அல்லது பிரான்சிடெட்டு அமிலம்|பிரான்சிடெட்டு அமிலத்துடன்]] வினைபுரிந்து உயர் நச்சான ஐதரசன் அசைடைத் தருகிறது.
- ஈய அசைடு போன்ற கனவுலோக அசைடுகள் முதல்நிலை வெடி பொருட்களாவும் தூண்டு வெடிகளாகவும் செயல்படுகின்றன. சோடியம் அசைடின் கரைசல் அல்லது சோடியம் அசைடு ஆவி , கனவுலோகங்கள் அல்லது அவற்றின் சேர்மங்களுடன் நேரடியாக வினை புரிவதால் கனவுலோக அசைடுகள் உருவாகின்றன.
- சோடியம் அசைடு மற்றும் பலபடி-பிணைப்பு அசைடு வினைப்பொருட்கள் முக்குளோரோமீத்தேன் மற்றும் குளோரோஃபார்ம் ஆகியனவற்றுடன் வினைபுரிந்து முறையே இரு மற்றும் மூவசிடோமீத்தேன்களை உருவாக்குகின்றன. இவையிரண்டும் உயர் அடர்த்தி கரைசலில் நிலைப்புத்தன்மை இல்லாமல் காணப்படுகின்றன. வினை கலவையின் அடர்த்தி அதிகமாகும்போது பல்வேறு பேரழிவு வெடிப்புகள் அறியப்படுகின்றன. இரு அசிடோமீத்தேன் மற்றும் மூவசிடோமீத்தேன் ஆகியவற்றின் தீங்குகள் யாவும் ஆவணப்படுத்தப்பட்டு வருகின்றன.[18][19]
- திண்மநிலை அயோடோ அசைடு வெடிக்கும் தன்மையுடையது என்பதால் கரைப்பான் இல்லாமல் இதைத் தயாரிக்கக் கூடாது.[20]
மேற்கோள்கள்[தொகு]
- ↑ 1.0 1.1 1.2 1.3 S. Bräse, C. Gil, K. Knepper and V. Zimmermann (2005). "Organic Azides: An Exploding Diversity of a Unique Class of Compounds". Angewandte Chemie International Edition 44 (33): 5188–5240. doi:10.1002/anie.200400657. பப்மெட்:16100733.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ). Butterworth–Heinemann. பக். 433. பன்னாட்டுத் தரப்புத்தக எண்:0080379419.
- ↑ "A New Route to Metal Azides". Angewandte Chemie. doi:10.1002/anie.201404561.
- ↑ R. O. Lindsay and C. F. H. Allen (1955). "Phenyl azide". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv3p0710.; Collective Volume, vol. 3, p. 710
- ↑ C. F. H. Allen and Alan Bell. "Undecyl isocyanate". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv3p0846.; Collective Volume, vol. 3, p. 846
- ↑ Jon Munch-Petersen (1963). "m-Nitrobenzazide". Organic Syntheses. http://www.orgsyn.org/demo.aspx?prep=cv4p0715.; Collective Volume, vol. 4, p. 715
- ↑ Pavitra Kumar Dutt, Hugh Robinson Whitehead and Arthur Wormall (1921). "CCXLI.—The action of diazo-salts on aromatic sulphonamides. Part I". J. Chem. Soc., Trans. 119: 2088. doi:10.1039/CT9211902088.
- ↑ Name Reactions: A Collection of Detailed Reaction Mechanisms by Jie Jack Li Published 2003 Springer ISBN 3-540-40203-9
- ↑ E. Dönges "Alkali Metals" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 475.
- ↑ Committee on Prudent Practices for Handling, Storage, and Disposal of Chemicals in Laboratories, Board on Chemical Sciences and Technology, Commission on Physical Sciences, Mathematics, and Applications, National Research Council. (1995). Prudent practices in the laboratory: handling and disposal of chemicals. Washington, D.C.: National Academy Press. பன்னாட்டுத் தரப்புத்தக எண்:0-309-05229-7. http://books.nap.edu/openbook.php?record_id=4911&page=165.
- ↑ I. C. Tornieporth-Oetting and T. M. Klapötke (1995). "Covalent Inorganic Azides". Angewandte Chemie International Edition in English 34 (5): 511–520. doi:10.1002/anie.199505111.
- ↑ Mangelinckx, S.; Van Vooren, P.; De Clerck, D.; Fülöp, F.; De Kimpea, N. (2006). "An efficient synthesis of γ-imino- and γ-amino-β-enamino esters". Arkivoc (iii): 202–209. http://www.arkat-usa.org/get-file/19626/.
- ↑ Reaction conditions: a) sodium azide 4 eq., acetone, 18 hours reflux 92% chemical yield b) isopropyl amine, titanium tetrachloride, diethyl ether 14 hr reflux 83% yield. Azide 2 is formed in a nucleophilic aliphatic substitution reaction displacing chlorine in 1 by the azide anion. The ketone reacts with the amine to an imine which tautomerizes to the enamine in 4. In the next rearrangement reaction nitrogen is expulsed and a proton transferred to 6. The last step is another tautomerization with the formation of the enamine 7 as a mixture of cis and trans isomers
- ↑ https://www.organic-chemistry.org/synthesis/N1H/reductionsazides.shtm
- ↑ Damon D. Reed and Stephen C. Bergmeier (2007). "A Facile Synthesis of a Polyhydroxylated 2-Azabicyclo[3.2.1]octane". J. Org. Chem. 72 (3): 1024–6. doi:10.1021/jo0619231. பப்மெட்:17253828.
- ↑ 16.0 16.1 Horst H. Jobelius, Hans-Dieter Scharff "Hydrazoic Acid and Azides" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. எஆசு:10.1002/14356007.a13_193
- ↑ Shriver and Atkins. Inorganic Chemistry (Fifth Edition). W. H. Freeman and Company, New York, pp 382.
- ↑ M. S. Alfred Hassner (1986). "Synthesis of Alkyl Azides with a Polymeric Reagent". Angewandte Chemie International Edition in English 25 (5): 478–479. doi:10.1002/anie.198604781.
- ↑ A. Hassner, M. Stern, H. E. Gottlieb and F. Frolow (1990). "Synthetic methods. 33. Utility of a polymeric azide reagent in the formation of di- and triazidomethane. Their NMR spectra and the x-ray structure of derived triazoles". J. Org. Chem. 55 (8): 2304–2306. doi:10.1021/jo00295a014.
- ↑ L. Marinescu, J. Thinggaard, I. B. Thomsen and M. Bols (2003). "Radical Azidonation of Aldehydes". J. Org. Chem. 68 (24): 9453–9455. doi:10.1021/jo035163v. பப்மெட்:14629171.