சமிக்ஞை கடத்துகை
இக்கட்டுரை கூகுள் மொழிபெயர்ப்புக் கருவி மூலம் உருவாக்கப்பட்டது. இதனை உரை திருத்த உதவுங்கள். இக்கருவி மூலம்
கட்டுரை உருவாக்கும் திட்டம் தற்போது நிறுத்தப்பட்டுவிட்டது. இதனைப் பயன்படுத்தி இனி உருவாக்கப்படும் புதுக்கட்டுரைகளும் உள்ளடக்கங்களும் உடனடியாக நீக்கப்படும் |
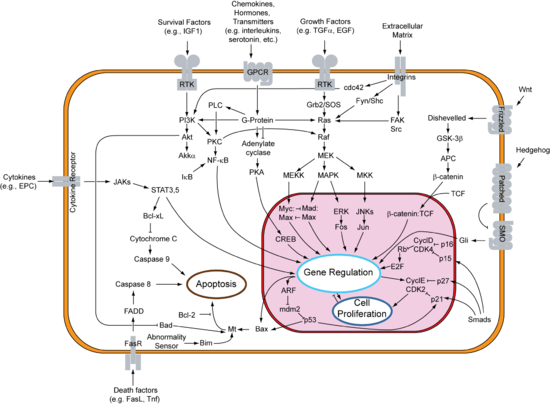
உயிரியலில், சமிக்ஞை கடத்துகை (Signal transduction) என்பது ஒரு செல்லானது ஒரு வகையான சமிக்ஞை அல்லது தூண்டலை மற்றொரு வகையாக மாற்றும் எந்த ஒரு செயலாக்கத்தையும் குறிக்கின்றது. சமிக்ஞை கடத்துகையின் பெரும்பாலான செயலாக்கங்கள் செல்லின் உள்ளே வரிசைப்படுத்தப்பட்ட உயிர்வேதியியல் விளைவுகளின் தொடர்வரிசையில் ஈடுபடுகின்றன, இவை என்சைம்களால் கொண்டு செல்லப்பட்டு இரண்டாம் தூதுவர்களால் செயலாக்கப்படுகின்றன, இதன் விளைவாக சமிக்ஞை கடத்துகை வழித்தடம் உண்டாகின்றது. இதுபோன்ற செயலாக்கங்கள் இயல்பாக துரிதமாக நடைபெறுகின்றன, அயனி பாய்ம வகையில் மில்லி வினாடிகளின் வரிசையில் நீடித்திருக்கின்றன, அல்லது புரதம்- கொழுப்பு-செயலூக்கப்பட்ட நொதி அடுக்குகள் ஆகியவற்றின் செயலாக்கத்திற்கு நிமிடங்கள் நீடிக்கின்றன, ஆனால் பல மணிநேரங்கள் எடுக்கலாம், மேலும் (மரபு வெளிப்பாடு உடனான நிகழ்வு போன்றவற்றில்) அந்த செயலாக்கத்தை நிறைவேற்ற நாட்கள் கூட ஆகலாம். சமிக்ஞை கடத்துகை ஈடுபடுகின்ற நிகழ்வுகளில் பங்குபெறுகின்ற புரதங்கள் மற்றும் பிற மூலக்கூறுகளின் எண்ணிக்கையானது தொடக்கத் தூண்டல்களிலிருந்து வெளிப்படுகின்ற செயலாக்கம் போன்று அதிகரிக்கின்றது, இதுசமிக்ஞை அடுக்கை விளைவிக்கின்றது, இது மிகப்பெரிய பதிலை வெளிக்கொணரும் தொடர்புடைய சிறிய தூண்டலுடன் தொடங்குகின்றது. இது சமிக்ஞை பெருக்கம் என்று குறிப்பிடப்படுகின்றது.
வரலாறு[தொகு]
முந்தைய அறிவியல் இதழானது MEDLINE தரவுத்தளத்தில், 1972 ஆம் ஆண்டில் வெளியிடப்பட்ட உரையில் சமிக்ஞை கடத்துகை என்ற குறிப்பிட்ட சொல்லைக் கொண்டிருப்பது போல் பதிவு செய்யப்பட்டது.[1]
1977 ஆம் ஆண்டிற்கு முன்னர் வெளியிடப்பட்ட கட்டுரைகளில் உள்ள சமிக்ஞை கடத்துகை அல்லது உணர்வு கடத்துகை என்ற சொல்லை அவற்றின் தலைப்புகளில் அல்லது சுருக்கங்களில் பயன்படுத்துகின்றன[2][3], ஆனால் அது 1977 ஆம் ஆண்டு வரையில் இல்லை, அந்த இதழ்கள் தங்களின் சுருக்கங்களில் சமிக்ஞை கடத்துகை என்ற சொல்லுடன் வெளியிடத் தொடங்கின, மேலும் அது 1979 ஆம் ஆண்டு வரையில் அந்தச் சொல் இதழின் தலைப்பில் தோன்றவில்லை.[4][5] 1980 ஆம் ஆண்டில் ராட்பெல் எழுதிய மதிப்புரைக்கு சமிக்ஞை கடத்துகை என்ற சொல்லின் பரவலான பயன்பாட்டை ஒரு ஆதாரம் விளக்குகின்றது.[6][7] வரைபடத்திலிருந்து பார்க்கும்போது, ஆராய்ச்சி இதழ்கள் சமிக்ஞை கடத்துகை செயலாக்கங்களை நேரடியாக குறிப்பிடுவது 1980களின் இறுதியிலும் 1990களின் ஆரம்பத்திலும் வந்த அறிவியல் இலக்கியத்தில் தோன்றத் தொடங்கியது.
ரோட்பெல் உருவாக்கிய வளர்சிதை மாற்ற நெறிமுறைக்கும் GTP மற்றும் GTP-கட்டமைந்த புரதங்கள்[7] ஆகியவற்றுக்கும் இடையேயான இணைப்பு சமிக்ஞை கடத்துகைத் துறையில் குறிப்பிடத்தக்க ஆரம்பகாலக் கண்டுபிடிப்பு ஆகும். சமிக்ஞை கடத்துகை செயலாக்கத்தின் தற்போதைய புரிதலானது உலகம் முழுவதிலுமுள்ள ஆராய்ச்சி குழுக்களால் பல ஆண்டுகள் அளிக்கப்பட்ட பங்களிப்புகளை பிரதிபலிக்கின்றது.
1977 ஆம் ஆண்டில் மொத்தம் 48,377 சமிக்ஞை கடத்துகை தொடர்பான அறிவியல் இதழ்கள் வெளிவந்தன; இதில் 11,211 இதழ்கள் பிற இதழ்களின் மதிப்புரைகள் ஆகும்.
சமிக்ஞை மூலக்கூறுகள்[தொகு]
பெரும்பாலான சமிக்ஞை கடத்துகை புறவணுக்கள் சமிக்ஞை மூலக்கூறுகளை (மற்றும் அணைவிகளை) அணு-மேற்பரப்பு வாங்கிகளுக்குக் கட்டமைத்தலில் ஈடுபடுகின்றன, அந்த வாங்கிகள் பிளாஸ்மா சவ்வு மற்றும் அணுவின் உள்ளே நிகழ்வுகள் தூண்டல் ஆகியவற்றிலிருந்து வெளிப்புறம் நோக்கி சந்திக்கின்றன. அணுக்களுக்கிடையேயான சமிக்ஞை அடுக்குகள் அணு-கீழ் அடுக்கு ஊடாடல்கள் வாயிலாக தூண்டப்படுகின்றன, இது புறவணுக்கள் தாயத்தில் காணப்படும் அணைவிகளைக் கட்டும் இண்டெக்ரின்கள் வகையினைப் போன்றது. ஸ்ட்டீராய்டுகள் புறவணுக்கள் சமிக்ஞை மூலக்கூறுகளின் மற்றொரு உதாரணத்தைக் குறிப்பிடுகின்றன, அவை தங்களின் கொழுப்பு விரும்பி அல்லது நீர் விலக்கி இயல்பின் காரணமாக பிளாஸ்மா சவ்வை கடக்கலாம்.[8] பெரும்பாலான ஸ்ட்டீராய்டுகள் சைட்டோப் பிளாசம் உள்ளே வாங்கிகளைக் கொண்டுள்ளன, ஆனால் அனைத்தும் ஸ்ட்டீராய்டுகளை கொண்டிருப்பதில்லை, மேலும் அவை வழக்கமாக ஸ்ட்டீராய்டு-ஏற்புத்தன்மை ஜீன்களின் வினையூக்கி மண்டலத்திற்கு அவற்றின் வாங்கிகளின் கட்டுப்படுத்தலை ஊக்குவிப்பதன் வாயிலாக செயல்படுகின்றன.[9] பலஅணுக்கள் உயிரினங்களில், பல சிறிய மூலக்கூறுகள் மற்றும் பாலிபெப்டைஸ் ஒரு அணுவின் தனிப்பட்ட உயிரியல் நடவடிக்கையை மொத்தமாக உயிரினம் என்ற ரீதியில் ஒருங்கிணைப்பதற்குச் செயல்படுகின்றன. இந்த மூலக்கூறுகள் செயல்பாடு அடிப்படையில் பின்வருமாறு வகைப்படுத்தப்பட்டுள்ளன:
- ஹார்மோன்கள் (எ.கா., மெலட்டோனின்),[10]
- வளர்ச்சிக் காரணிகள் (எ.கா. மேற்றோலுக்குரிய வளர்ச்சிக் காரணி),[11]
- புறவணுக்கள் தாய கூறுகள் (எ.கா., பைப்ரோனெக்டின்),[12]
- சைட்டோகீன்கள் (எ.கா., இண்ட்டர்ஃபெரான்-காமா),[13]
- செமோக்கீன்கள் (எ.கா., ரேண்டஸ் (RANTES)),[14]
- நரம்பியக்கடத்திகள் (எ.கா., அசெட்டைல் கோலின்),[15] மற்றும்
- நியூட்ரோபின்கள் (எ.கா., நரம்பு வளர்ச்சிக் காரணி).[16]
- இயங்கு ஆக்சிஜன் இனம் ( காண்க, ரெடாக் சமிக்ஞை).
இந்த வகைப்பாடுகளின் பெரும்பான்மை ஒவ்வொரு வகை உறுப்புகளின் மூலக்கூறு இயல்பை கணக்கில் எடுத்துக்கொள்ளாது. எடுத்துக்காட்டாக, ஒரு வகை, நரம்பியக்கடத்திகள் எண்ட்ரோபின்கள் போன்ற நியுரோபெப்டைட்களை[17] மற்றும் செரோடோனின் போன்ற சிறிய மூலக்கூறுகள்[18] மற்றும் டோபமைன் ஆகியவற்றைக் கொண்டிருக்கின்றன.[19] ஹார்மோன்கள், மூலக்கூறுகளின் மற்றொரு பொதுவான வகை, இவை இன்சுலின் (பாலிபெப்டைடு),[20] டெஸ்டோஸ்டிரோன் (ஸ்டீராய்டு),[21] மற்றும் எப்பின்நெப்பிரின் (அமினோ அமில வழிப்பொருள், சிறிய உயிரின மூலக்கூறு அடிப்படையிலானது) உள்ளிட்ட தொடக்க சமிக்ஞை கடத்துகையின் கொள்திறன் கொண்டவை.[22]
ஒரு வகையில் அல்லது மற்றொன்றில் ஒரு மூலக்கூறின் வகைப்பாடு சரியாக இருப்பதில்லை. எடுத்துக்காட்டாக, எப்பினெப்பிரின் மற்றும் நோரேபினெப்பிரின் ஆகியவை நரம்பியக்கடத்தியாக செயல்பட மைய நரம்பியல் அமைப்பு வாயிலாக சுரக்கப்பட்டன. இருப்பினும், எப்பினெப்பிரின் அட்ரீனல் மெடுல்லா மூலமாக சுரக்கப்படுகையில் ஹார்மோனாக செயல்படுகின்றது.
சுற்றுச்சூழல் தூண்டுகை[தொகு]
பாக்டீரியா மற்றும் பிற ஒற்றை-அணு உயிரினங்களில், அதன் சூழலுக்கு அதனால் முடிந்த பல்வேறு வழிகளில் செயல்பட மற்றும் மறுமொழி அளிக்கும் பாதிப்புத் திறன்களைக் கொண்ட அணு பல்வேறு வகையான சமிக்ஞை கடத்துகைச் செயல்பாடுகளை கொண்டுள்ளது.[சான்று தேவை] பலமூலக்கூறு உயிரினங்களில், மொத்தமாக உயிரினத்தின் செயல்பாட்டை ஆதரிக்கத் தனிப்பட்ட அணுக்களின் நடத்தையை ஒருங்கிணைத்தலுக்கு பல்வேறு சமிக்ஞை கடத்துகை செயல்பாடுகள் அவசியமாகின்றன. உயிரினத்தின் சிக்கல் தன்மையான சமிக்ஞை கடத்துகை செயலாக்கங்கள் உயிரினத்தின் ஊடாக சிக்கல் தன்மையை அதிகரிக்கும் அணுகுமுறையைக் கொண்டது.[சான்று தேவை] அணுக்களின் நிலையில் அக மற்றும் புற சுற்றுச்சூழல்களின் உணர்வு சமிக்ஞை கடத்துகையில் அமைந்துள்ளது. [சான்று தேவை] நீரிழிவு, இதய நோய்கள், தன்தடுப்பாற்றல் மற்றும் புற்றுநோய் போன்ற பல்வேறு நோய் செயல்பாடுகள் சமிக்ஞை கடத்துகை வழித்தட குறைபாடுகளிலிருந்து ஏற்படுகின்றன, மேலும் உயிரியல் அதே போன்று மருத்துவம் ஆகியவற்றில் சமிக்ஞை கடத்துகையின் சிக்கலான முக்கியத்துவம் குறிப்பிடப்படுகின்றது.
பல்வேறு சுற்றுச்சூழல் தூண்டுகையில் கூடுதலாக பல வழக்கமான சமிக்ஞை கடத்துகை தூண்டுகையின் சிக்கலான உயிரனங்களில் சமிக்ஞை பரப்பு செயலாக்கங்களின் தொடக்கம் மேலே பட்டியலிடப்பட்டுள்ளது. சுற்றுச்சூழல் தூண்டுகை இயல்பில் (மேலே கூறியபடி) அல்லது வடிவில், கண்ணின் ரெட்டினாவில் ஒளியை உமிழும் அணுக்கள்,[23] மூக்கின் எபித்தெலியமில் மணக்கும் தன்மையுடைய வாங்கிகளைக் கட்டுகின்ற மணக்கும் பொருள்கள்,[24] மற்றும் சுவையரும்புகளில் கசப்பு மற்றும் இனிப்புச் சுவைகளைத் தூண்டுகின்ற சுவை வாங்கிகள் போன்ற மூலக்கூறாக இருக்கலாம்.[25] குறிப்பிட்ட நுண்ணுயிர்களின் மூலக்கூறுகள், எ.கா., வைரஸ் நியூக்ளியோட்டைடுகள், பாக்டீரியா கொழுப்புப்பலசக்கரைகள் மற்றும் புரத வெளிப்புரதங்கள் ஆகியவை ஒரு நோய் எதிர்ப்பு மண்டலத்தை நோய்க்கிருமிகள் படையெடுப்புக்கு எதிராகச் செயல்படத் தூண்டும் இயல்புடையன, இவை சமிக்ஞை கடத்துகை செயலாக்கங்களால் தூண்டப்படுகின்றது. ஒரு நோய் எதிர்ப்பு செயலானது பிற மூலக்கூறுகளால் சமிக்ஞை கடத்துகை தூண்டலின் கட்டுப்பாடின்றி நிகழலாம், இது டோல்-போன்ற வாங்கி அல்லது பிற செல்களின் அணு மேற்பரப்பில் அமைந்துள்ள தூண்டு மூலக்கூறுகளின் உதவியுடன் சமிக்ஞை கடத்துகைக்கான வகை போன்று உள்ளது, டி-அணு வாங்கி சமிக்ஞைக்கான வகை போன்றும் உள்ளது.
ஒற்றையணு உயிரனங்கள் சமிக்ஞை கடத்துகை வழித்தடங்களை செயலாக்குவதன் மூலமாக சுற்றுச்சூழல் தூண்டுகைக்குப் பதிலளிக்கலாம். எடுத்துக்காட்டாக, பசை சணங்கள் பற்றாகுறையில் சுழற்சி-AMP ஐ சுரக்கின்றன, இது உடனடிச் சூழலில் தனிப்பட்ட அணுக்களை மதிப்பிடத் தூண்டுகின்றது.[26] ஈஸ்ட்கள் கலப்பு காரணிகளை பிற ஈஸ்ட்களின் கலப்பு வகைகளைக் கண்டறியவும் மற்றும் பாலினப்பெருக்கத்தில் பங்குபெறவும் பயன்படுத்துகின்றது.[27]
அணு மறுமொழிகள்[தொகு]
மரபணுக்களின் செயலாக்கம்,[28] வளர்சிதை மாற்றத்தில் மாற்றுக்கள்,[29] அணுவின் தொடர்ந்த பெருக்கம் மற்றும் இறப்பு,[30] இடப்பெயர்ச்சியின் தூண்டல் அல்லது ஒடுக்கம்[31] ஆகியவை சமிக்ஞை கடத்துகைக்கு அவசியமான, அதிகமான அணுத் தூண்டலுக்கு அணுவின் பல மறுமொழிகளாக உள்ளன. மறுமொழியளிக்கின்ற மரபணுக்கள் பலவற்றின் புரதத் தயாரிப்புகளானவை என்சைம்கள் மற்றும் படியெடுத்தல் காரணிகளை அவைகளுக்குள்ளாகவே சேர்ப்பதால் மரபணு செயலாக்கம் மேலும் அணுக்கரு விளைவுகளுக்கு வழிவகுக்கின்றது. படியெடுத்தல் காரணிகள் சமிக்ஞை கடத்துகளை அடுக்கின் விளைவாக தயாரிக்கப்படுகின்றன, இவை இன்னும் பல மரபணுக்களை செயலாக்கலாம். எனவே ஒரு தொடக்க தூண்டி மொத்த மரபணுக்கள் பெருங்குடும்பத்தின் வெளிப்படுத்தும் தன்மையைத் தூண்டுகின்றது, மேலும் இது ஏதேனும் சிக்கலான உடலியல் நிகழ்வுகள் பலவற்றை செயலாக்கவும் வழிவகுக்கலாம். இந்த நிகழ்வுகள் இன்சுலின் மூலமாக தூண்டப்பட்ட குருதியோட்டத்திலிருந்து உயர்த்தப்பட்ட சர்க்கரையின் அதிகரிப்பு[29] மற்றும் பாக்டீரியா தயாரிப்புகளால் தூண்டப்பட்ட கிருமித் தொற்றுத் தளங்களுக்கு நியூட்ரோஃபில்களின் மாற்றம் ஆகியவற்றைச் சேர்க்கின்றது. மரபணுக்களின் தொகுப்பு தூண்டிக்கு பதிலளிக்கையில் இயக்கப்பட்டவையின் வரிசை ஆகியவை பெரும்பாலும் மரபணு திட்டம் என்று குறிப்பிடப்படுகின்றது.[32]
நரம்பியல் கடத்திகள் என்பவை அணைவிகள் ஆகும், அவை அயனி வழி புரதங்களைக் கட்டும் திறனுடையவை, அதன் விளைவு அவற்றின் தொடக்கத்தில் பிளாஸ்மா சவ்வின் இடையே குறிப்பிட்ட அயனியின் விரைவான ஓட்டத்தை அனுமதிக்கின்றது.[15] இது அணுவின் சவ்வு சாத்தியக்கூற்று மாற்றத்தை விளைவிக்கின்றது மற்றும் இது மின்வேதியியல் தூண்டல்களின் நரம்பியல் கடத்துகை போன்ற செயலாக்கங்களுக்கு முக்கியமானதாக உள்ளது. அணைவிகள் கட்டுப்பாடின்றி கரையத்தக்கவையாக இருக்கும்,[11] அல்லது பிற அணுக்களின் மேற்பரப்பில் அல்லது புறவணுவின் தாயத்தின் ஊடே காணப்படும்.[12] இண்டெகிரீன்கள் நாரியற்செல்களின் அணு மேற்பரப்பு ஃபிப்ரோநெக்டினில் ஈடுபடுகையினால், அணு மேற்பரப்புகள் அல்லது புறவணுவின் தாய அணைவிகள் போன்றவை அணுக்கள் ஒன்றையொன்று தொடர்புகொள்ளும் போது, விழுங்கணு நிணநீர்க்கலங்களுக்கு நோய் எதிரணு உற்பத்தி ஊக்கிகளை அளிக்கின்ற போது, அல்லது புறவணு தாயத்திற்கு ஒட்டுதலில் போன்று சமிக்ஞையளிக்கின்றன.[33]
பெரும்பாலான பாலூட்டி அணுக்களுக்கு, அணு பிளவைக் கட்டுப்படுத்த மட்டுமல்லாமல் உயிர்வாழ்வதற்கும் தூண்டல் அவசியம். வளர்ச்சிக் காரணி தூண்டல் இல்லாத போது, திட்டமிட்ட அணு இழப்பு பெரும்பாலான அணுக்களுக்கும் பரவுகின்றது. மிகை-அணு தூண்டலுக்கான அவசியங்கள் போன்றவை ஒற்றையணு மற்றும் பல-அணு உயிரனங்கள் இரண்டு வகையிலும் அணு நடவடிக்கையை கட்டுப்படுத்துதலுக்கு அவசியமாகின்றன. சமிக்ஞை கடத்துகை வழித்தடங்கள் உயிரியியல் செயலாக்கத்திற்கு மிகவும் பொதுவானதாக இருப்பதாக முன்பு கணிக்கப்பட்டுள்ளன, மிகவும் அதிக எண்ணிக்கையிலான நோய்கள் அவற்றின் கட்டுப்பாடின்மையை அளிக்கின்றது என்பது வியப்பானது அல்ல.
எவ்வாறு வாங்கியின் பல்வேறு பிரிவுகளின் வழியே சமிக்ஞை கடத்துகையானது மேலே கூறப்பட்ட அணு மறுமொழிகளுக்கு வழிவகுக்கலாம் என்பது கீழே விவாதிக்கப்பட்டுள்ளது.
வாங்கிகளின் வகைகள்[தொகு]
வாங்கிகளை தோராயமாக இரண்டு முக்கியப் பிரிவுகளாகப் பிரிக்கலாம், அவை:
- அணுவிற்குள்ளான வாங்கிகள் மற்றும்
- அணு-மேற்பரப்பு வாங்கிகள்.
அணைவி-கட்டுப்படுத்திய அயனி வழி வாங்கிகள் என்பவை வாங்கியின் ஒரு வகையாகும், அவை அணு-மேற்பரப்பு அல்லது அணுவினுடன் இரண்டிலும் நிகழலாம்.
ஸ்ட்டீராய்டு ஹார்மோன்கள், தைராய்டு ஹார்மோன், ரெடினோயிக் அமிலம் மற்றும் வைட்டமின் D3|வைட்டமின் D3 இன் வழிப்பொருட்கள் ஆகியவற்றுக்கானவை தனிப்பட்ட முறையில் அணுவினூடேயான வாங்கிகள் ஆகின்றன. அணைவிகள் சமிக்ஞை கடத்துகையைத் தொடங்க அணு மேற்புற வாங்கிகளைக் கட்டுகின்றன, மாறாக, இந்த அணைவிகள் கண்டிப்பாக அணுச் சவ்வைக் கடக்கின்றன. மேலும் தகவலுக்கு கீழே உள்ள அணுவினூடேயான வாங்கிகள் பிரிவைக் காண்க.
G-புரதம் இணைக்கப்பட்ட வாங்கிகள் மற்றும் தைரோசின் கினாஸ் வாங்கிகள் உள்ளிட்டவை அணுவினூடேயான வாங்கிகளின் முக்கிய வகைகள் ஆகும்.
அணு மேற்பரப்பு வாங்கிகள்[தொகு]
அணு மேற்பரப்பு வாங்கிகள் தொகுப்பு மாற்றுமென்படலம் புரதங்களாக உள்ளன மற்றும் மிகயணு சமிக்ஞை மூலக்கூறுகளின் மிகை முதன்மையை அடையாளம் காணுகின்றது. மாற்றுமென்படல வாங்கிகள், அணுவிற்கு வெளியே (புறவணு களம் ) அமைந்துள்ள ஏற்பியின் ஒரு பகுதியுடன் மற்ற அணுவின் உள்ளே (அகவணு களம் ) அமைந்துள்ள பகுதியுடன் அணுவின் பிளாஸ்மா சவ்வை பரவலாக்குகின்றது. சமிக்ஞை கடத்துகையானது உருவகப்படுத்தல் மூலக்கூறின் விளைவாக அல்லது அணைவியை அதன் புறவணுக் களத்தில் கட்டுதலில் நிகழ்கின்றது; அணைவியானது அதனூடே வாங்கி-கட்டுதலுக்கு முன்னர் பிளாஸ்மா சவ்வு வாயிலாக செலுத்தப்படாது.
ஒரு அணு-மேற்பரப்பு வாங்கிக்கு அணைவியின் கட்டுதலானது அணுவின் ஊடே நிகழ்வுகளின் தொடரை வேறுபட்ட அகவணு மறுமொழிகளின் வேறுபட்ட வாங்கி உருவகப்படுத்தலுடன் உருவகப்படுத்துகின்றது. பொதுவாக வாங்கிகளானவை குறிப்பிட்ட அணைவியின் கட்டுதலுக்கு மட்டுமே பதிலளிக்கின்றன. கட்டுதலில், அணைவியானது வாங்கியின் அகவணுப் பகுதியின் வடிவத்தில் அல்லது உறுதிப்படுத்தலில் உய்த்துணர்தல் மூலமாக பிளாஸ்மா சவ்வின் இடையே சமிக்ஞையின் பரப்புகையைத் தொடங்குகின்றது (வாங்கியின் செயலாக்கத்திற்கான மூலக்கூறு மாதிரிக்கு இந்த இணைப்பைக் காண்க [3]). பெரும்பாலும் இது போன்றவை, வாங்கியில் கொண்டிருக்கும் நொதித்தல் செயல்பாட்டின் செயலாக்கத்தில் அல்லது அணுவில் பிற சமிக்ஞை புரதங்களுக்கான கட்டுதல் தளத்தை வெளிப்படுத்துதல் விளைவை உறுதிப்படுத்துதலில் மாற்றங்களைக் ஏற்படுத்துகின்றது. இந்த புரதங்கள் வாங்கிகளுக்கு கட்டப்பட்டால், அவை தங்களுக்குள்ளாகவே செயலாக்கப்பட்டு சமிக்ஞையை சைட்டோப் பிளாசத்தில் பரப்பலாம்.
நிறைவு நிலை பெற்ற அணுக்களில், அணைவி அல்லது புரத ஊடாடலால் செயலாக்கப்பட்ட பெரும்பாலான அகவணு புரதங்கள் நொதித்தல் செயல்பாட்டைக் கொண்டுள்ளன. இந்த என்சைம்கள் தைரோசின் கினேஸ், ஹைட்ரோமெட்ரிக் G புரோட்டீன்கள், சிறிய GTபேஸ்கள், பல்வேறு சைரின்/தெரியோயின் புரோட்டீன் கினேஸ்கள், பாஸ்பேட்டுகள், கொழுப்பு கினேஸ்கள், மற்றும் ஹைட்ரோலேஸ்கள் ஆகியவற்றைக் கொண்டுள்ளன. பல வாங்கி உருவகப்படுத்தப்பட்ட என்சைம்களாவன சுழற்சி AMP (cAMP) மற்றும் சுழற்சி GMP (cGMP) போன்ற சுழற்சி நியூக்ளியோட்டைடுகள், பாஸ்பேட்டிடைலினோசிட்டால்-டிரைபாஸ்பேட் (PIP3), டையாசைல்கிளைசரால் (DAG) மற்றும் லினோசிட்டால்-டிரைபாஸ்பேட் (IP3), IP3|IP3 போன்ற பாஸ்பேட்டி டை லினோசிட்டால் வழிப்பொருட்கள் உள்ளிட்ட குறிப்பிட்ட இரண்டாம் தூதுவர்களை உருவாக்குகின்றன, இவை சைட்டோபிளாசத்தில் அகவணு கால்சியம் சேமிப்புகளின் வெளியீட்டைக் கட்டுப்படுத்துகின்றன (இந்த கட்டுரையின் பின்பகுதியில் உள்ள இரண்டாம் தூதுவர்கள் பிரிவைக் காண்க). பிற செயலாக்கப்பட்ட புரதங்கள் ஏற்பி புரதங்களுடன் ஊடாடுகின்றன. ஏற்பி புரதங்கள் பிற சமிக்ஞை புரதங்களிடையேயான ஊடாடல்களை அம்சமாக்குகின்றன. மேலும் இவை குறிப்பிட்ட தூண்டிக்கு சரியான அணு மறுமொழியை உருவாக்கத் தேவையான சமிக்ஞை சிக்கல்களின் அமைத்தலை வழி நடத்துகின்றன. என்சைம்கள் மற்றும் ஏற்பி புரதங்கள் ஆகியவை இரண்டும் பல்வேறு இரண்டாம் தூதுவர்கள் மூலக்கூறுகளுக்குப் பொறுப்பாக உள்ளன.
பல்வேறு என்சைம்கள் சமிக்ஞை கடத்துகை இயந்திர உத்தியின் பகுதியாக செயலாக்கப்பட்டன, மேலும் பல ஏற்பிப் புரதங்களும் குறிப்பிட்ட இரண்டாம் தூதுவர் மூலக்கூறுகளுக்குக் கட்டப்படுகின்ற தனிசிறப்பாக்கப்பட்ட புரத களங்களுக்கு சொந்தமாக்கப்படுவதைக் கண்டறிகின்றன. எடுத்துக்காட்டாக, கால்சியம் அயனிகள் குறிப்பாக கால்மாடுலின் EF கைக் களங்களைக் கட்டுகின்றன, இவை கால்மால்டுலின்-சார்ந்த கினேஸை கட்டவும் செயலாக்கவும் இந்த மூலக்கூற்றை அனுமதிக்கின்றன. PIP3, PIP2 மற்றும் பிற பாஸ்போனிசைடிடேட்கள் கைனேஸ் புரதம் AKT போன்ற புரதங்களின் மீண்டும் செயலாக்க நடவடிக்கையுடன் கட்டலாம்.
வேறுபட்ட புறவணு சமிக்ஞை மூலக்கூறுகளை அங்கீகரிக்கும் மாற்றுமென்படல வாங்கியின் பல வேறுபட்ட வகைகளும் உள்ளன. இந்த கட்டுரையில் விவாதிக்கப்பட்டுள்ள குறிப்பிட்ட எடுத்துக்காட்டு வாங்கிகள், கீழே:
- G-புரதப் பிணைப்பு வாங்கிகள், எ.கா., செமோக்கின் வாங்கிகள்
- வாங்கி டைரோசின் கைனேஸ்கள், எ.கா., வளர்ச்சிக் காரணி வாங்கிகள்,
- இண்டெகிரின்கள்
- உயிரிழப்பு போன்ற வாங்கிகள்
மாற்றுமென்படல வாங்கி கட்டுரையில் மேலும் உதாரணங்கள் தரப்பட்டுள்ளன.
G-புரதப் பிணைப்பு வாங்கிகள்[தொகு]
G-புரத-பிணைப்பு வாங்கிகள் (GPCRகள்) ஒருங்கிணைந்த சவ்வு புரதங்களின் குடும்பமாக உள்ளன, இவை ஏழு சவ்வு-பரவல் களங்களை சொந்தமாகக் கொண்டுள்ளன, மேலும் அவை ஒரு குவானீன் நியூக்ளியோடைட்-கட்டமைப்பு புரதத்தை (அல்லது ஹீட்டரோடிரைமெட்ரிக் G புரதத்தை) இணைக்கின்றன. பல்வேறு வாங்கிகள், அட்ரீனல்வினையிய வாங்கிகள், நரம்பியகடத்துகை வாங்கிகள், நுகர்வு வாங்கிகள், ஆப்பியாய்டு வாங்கிகள், செமோகின் வாங்கிகள் மற்றும் ராடாப்சின் உள்ளிட்ட இந்த குடும்பத்தை உருவாக்குகின்றன.
GPCR மூலம் சமிக்ஞை கடத்துகை வாங்கிக்கு செயலற்ற G புரதப் பிணைப்புடன் தொடங்குகின்றது. ஒரு செயலற்ற G புரதம் ஹீட்டரோடிரைமெராக உள்ளது, இது பின்வரும் மூன்று வேறுபட்ட புரத துணையலகுகளின் இணைக்கப்பட்ட மூலகூறாகும்: Gα, Gβ மற்றும் Gγ. GPCR அணைவியை அடையாளம்கண்டு விட்டால், வாங்கியின் வடிவம் (உறுதிப்படுத்தல்) G புரதத்தை இயந்திரப்பூர்வமாக செயலாக்க மாற்றுகின்றது, மேலும் causes GTP மூலக்கூற்றை (செயலாக்கத்தை விளைவிப்பது) கட்டும் ஒரு துணையலகை (Gα) விளைவிக்கின்றது மற்றும் மற்ற இரண்டு G-புரத துணையலகுகளில் (Gβ மற்றும் Gγ) இருந்து தொடர்பை பிரிக்கிறது. தொடர்பை பிரித்தலானது பிற மூலக்கூறுகளுடன் ஊடாடுகின்ற G-புரத துணையலகுகளில் தளங்களை வெளிப்படுத்துகின்றது.[34] செயலாக்கப்பட்ட G புரத துணையலகுகள் வாங்கியிலிருந்து பிரிக்கப்பட்டு பாஸ்போடைஎஸ்டரேஸ்கள் மற்றும் அடீனைல் சைக்ளாஸ்கள், பாஸ்போலிபேஸ்கள் மற்றும் சுழற்சி-GMP (cGMP), ஐனோசிட்டால் டிரைபாஸ்பேட் (IP3), டையசைல்கிளைசரால் (DAG) மற்றும் கால்சியம் (Ca2+) அயனிகள்|கால்சியம் (Ca2+) அயனிகள் போன்ற இரண்டாம் தூதுவர் மூலக்கூறுகளின் வெளியீட்டை அனுமதிக்கின்ற அயனி வழிகள் உள்ளிட்ட பல்வேறு கீழ்நிலை ஓட்ட செயலுறுப்பு புரதங்களிலிருந்து சமிக்ஞையை தொடங்குகின்றன.[35] எடுத்துக்காட்டாக, போட்டான் மூலம் செயலாக்கப்பட்ட கண்ணில் ஒரு விழித்திரையின் அணுவின் பிளாஸ்மா சவ்விலுள்ள ராடாப்சின் மூலக்கூறானது ஒரு வினாடிக்கு 2000 செயலுறுப்பு மூலக்கூறுகளை (இந்த நிகழ்வில், கடத்துகையை) செயலாக்க முடியும்.
GPCR மூலமான சமிக்ஞைப் பெருக்கத்தின் மொத்த வலிமையானது பின்வருவனவற்றால் கண்டறியப்படுகின்றது:
- அணைவி-வாங்கி-பிணைப்பின் ஆயுட்காலம். அணைவி-வாங்கி-பிணைப்பானது நிலையாக இருந்தால், அது அணைவியை அதன் வாங்கியிலிருந்து பிரிக்க நீண்டநேரம் எடுத்துக்கொள்கின்றது, எனவே வாங்கியானது நீண்டநேரம் இயக்கத்தில் இருந்து மேலும் செயலுறு புரதங்களைச் செயலாக்குகின்றது.
- வாங்கி-செயலுறு புரதம்-பிணைப்பின் எண்ணிக்கை மற்றும் ஆயுட்காலம். அதிகமான செயலுறு புரதமானது வாங்கியால் செயலாக்கப்பட கிடைக்கின்றது, மேலும் வேகமாக செயலாக்கப்பட்ட செயலுறு புரதமானது வாங்கியிலிருந்து பிரிய முடியும், அதிகமான செயலுறு புரதமானது அதே காலகட்டத்தில் செயலாக்கப்படும்.
- செயலாக்கப்பட்ட வாங்கியின் செயலிழப்பு. ஒரு ஹார்மோன்-வாங்கி-பிணைப்பில் ஈடுபட்டுள்ள வாங்கியை சக இணைப்பு மாற்றம் (எடுத்துக்காட்டாக, பாஸ்போரைலேஷன்) மூலமாகவோ அல்லது உட்புறமாக்கல் (காண்க அபிகுயிட்டின்) மூலமாகவோ செயலாக்க முடியும்.
- உள்ளார்ந்த நொதித்தல் செயல்பாடு வாயிலான செயலுறுப்புகளின் செயலிழப்பு. சிறிய அல்லது பெரிய G-புரதங்கள் உள்ளார்ந்த GTபேஸ் நடவடிக்கையைச் சொந்தமாகக் கொண்டுள்ளன, இந்த நடவடிக்கையானது செயல்படுத்தப்பட்ட சமிக்ஞையின் கால அளவைக் கட்டுப்படுத்துகின்றது. இந்த நடவடிக்கையானது GTபேஸ்-செயலாக்க புரதங்கள் (GAPS) போன்ற பிற புரதங்களின் நடவடிக்கை மூலமாக அதிகரிக்கலாம்.
G-புரத-இணைப்பு வாங்கிகள் சிந்தனையானது, குறிப்பாக ஒரு ஆய்வில் பரிந்துரைத்ததன்படி செமோகீன் வாங்கிகள் புற்றுநோய் உருவாக்கத்தில் பங்குபெறுகின்றன, அதில் புள்ளித் திடீர் மாற்றமானது செமோகீன் வாங்கி CXCR2 ஐ மரபணு குறிப்படுத்துதலில் சேர்த்தது. CXCR2 மாற்றியுடன் அணுக்கள் மாற்றம் கொடிய உருமாற்றத்தை உட்படுத்துகின்றது.[36] புள்ளித் திடீர் மாற்றத்தின் விளைவானது உறுதிப்படுத்தல் நிலையில் CXCR2 இன் வெளிப்பாடாக இருந்தது, இருப்பினும் செமோகீன்-கட்டுதல் இல்லை (CXCR2 மாற்றியானது "இயைபில் இருப்பதாக" கூறப்பட்டுள்ளது).
வாங்கி டைரோசின் கைனேஸ்[தொகு]
வாங்கி டைரோசின் கைனேஸ்கள் (RTKகள்) அகவணு கைனேஸ் களம் மற்றும் அணைவி கட்டுண்டுள்ள புறவணு களம் ஆகியவற்றுடன் மாற்றுமென்படல புரதங்களாக உள்ளன. கட்டமைப்பு பண்புகள் மற்றும் அணைவி தனிக்குறிப்புத் தன்மை ஆகியவற்றின் அடிப்படையில் துணைக்குடும்பங்களாக வகைப்படுத்தப்பட்டுள்ள பல RTK புரதங்களைக் கொண்டுள்ளன. இவை இன்சுலின் வாங்கி மற்றும் இன்சுலின் போன்ற வளர்ச்சி காரணி வாங்கிகள் மற்றும் பல மற்ற வாங்கிகள் போன்ற பல்வேறு வளர்ச்சி காரணி வாங்கிகளைக் கொண்டுள்ளன.[37] அவற்றின் உயிர்வேதியியல் சமிக்ஞைகளைத் தொடர்புகொள்ள, RTKகள் பிளாஸ்மா சவ்வில் இருபடிகளை அமைப்பது அவசியம்[38]. இருபடியானது வாங்கிகளால் கட்டுண்டுள்ள அணைவியால் நிலைப்படுத்தப்படுகின்றது. இருபடியின் இரண்டு சைட்டோபிளாஸ்மிக் களங்களுக்கு இடையேயான தொடர்பானது RTKகளின் சைட்டோபிளாஸ்மிக் தைரோசின் கைனேஸ் களங்க ஏற்படுத்துகின்ற அவற்றின் உறுப்படுத்தல் மாற்றங்களுடன் தைரோசீன்களின் தானியங்கு பாஸ்போரைலேஷன் தூண்டுதலாகக் கருதப்படுகின்றது. வாங்கிகளின் கைனேஸ் களமானது தொடர்ச்சியாக செயலாக்கப்பட்டுள்ளது, இது கீழ்நிலை ஓட்ட சைட்டோபிளாஸ்மிக் மூலக்கூறுகளின் பாஸ்போரைலேஷனின் சமிக்ஞை அடுக்குகளைத் தொடங்குகின்றது. இந்த சமிக்ஞைகள் செல்லின் வளர்ச்சிக் கட்டுப்பாடு, வேறுபாடு கண்டறிதல், வளர்சிதை மாற்றம் மற்றும் குடி பெயர்தல் போன்ற பல்வேறு அணு செயலாக்கங்களுக்கு அவசியமாக உள்ளன.[37]
G-புரத-பிணைப்பு வாங்கிகள் நிகழ்வினால், GTP கட்டுண்டுள்ள புரதங்கள் செல்லில் செயலாக்கப்பட்ட RTK இலிருந்து சமிக்ஞை பரப்புதலில் முக்கியப் பங்கு வகிக்கின்றது. இந்த நிகழ்வில், G புரதங்கள் ராஸ், ரோ மற்றும் ராஃப் குடும்பங்களின் உறுப்பினர்களாக உள்ளன, இவை மொத்தமாக சிறிய G புரதங்கள் எனக் குறிப்பிடப்படுகின்றன. இந்தப் புரதங்கள் மூலக்கூறு நிலைமாற்றிகளாகச் செயல்படுகின்றன, அவை இயல்பாக சவ்வுகளில் ஐசோப்ரனைல் குழுக்களால் கட்டப்பட்டு அவற்றின் கார்பாக்ஸைல் புள்ளிகளில் இணைக்கப்பட்டுள்ளன. எனவே செயலாக்கத்தில், சமிக்ஞையில் கலந்துகொள்ளுகின்ற குறிப்பிட்ட சவ்வு துணைக்களங்களுக்கு புரதங்களைத் தேர்தெடுத்தலுக்குப் பொறுப்பேற்கின்றன. முறைப்படி வரும்போது செயலாக்கப்பட்ட RTKகள் சிறிய G புரதங்களைச் செயலாக்குகின்றன, இதன் முறையில் SOS1 போன்ற குவானின் நியூக்ளியோடைட் பரிமாற்ற காரணிகளை செயலாக்குகின்றன. ஒருமுறை செயலாக்கப்பட்ட பின்னர், இந்த பரிமாற்ற காரணிகள் மேலும் பல சிறிய G-புரதங்களை செயலாக்க முடியும், எனவே வாங்கிகளின் தொடக்க சமிக்ஞையை பெருக்குகின்றது.
G-புரத இணைப்பு வாங்கிகளின் திடீர்மாற்றத்தால், குறிப்பிட்ட RTK மரபணுக்களின் திடீர்மாற்றம் இயைபு செயலாக்க நிலையில் இருக்கின்ற வாங்கிகளின் வெளிப்பாட்டில் முடிவடையலாம். இதுபோன்ற மாற்றப்பட்ட RTK மரபணுக்கள் புற்றுநோய் ஏற்படுத்தும் மரபணுக்களாகச் செயல்படலாம், இந்த மரபணுக்கள் புற்றுநோயின் தொடக்கத்திற்கு அல்லது தீவிரமடைதலுக்குப் பங்களிக்கின்றன.[39]
இண்டெகிரின்கள்[தொகு]
இண்டெகிரீன்கள் பல்வேறு வகையான அணு வகைகளால் உற்பத்தி செய்யப்படுகின்றன, இவை புறவணு தாயம் (ECM) மற்றும் பிற அணுக்கள் ஆகியவற்றுக்கு அணுவின் இணைப்பிலும், மேலும் பைப்ரோனெக்டின், காலஜென் மற்றும் லெமனின் போன்ற புறவணு தாயக் கூறுகளிலிருந்து பெறப்பட்ட சமிக்ஞைகளின் சமிக்ஞை கடத்துகையிலும் பங்கு வகிக்கின்றன. இண்டெகிரீன்களின் புறவணு களத்திற்கு அணைவி-கட்டலானது சமிக்ஞை கடத்துகையை தொடங்க அணு மேற்பரப்பிலுள்ள புரதம் மற்றும் புரதத் தொகுப்பு ஆகியவற்றில் உறுதியான மாற்றத்தைத் தூண்டுகின்றது. இண்டெகிரீன்கள் கைனேஸ் செயல்பாட்டில் பாற்றாக்குறையுடன் உள்ளன, மேலும் இண்டெகிரீன்-மூலமான சமிக்ஞை கடத்துகையானது இண்டெகிரீன்-இணைக்கப்பட்ட கைனேஸ் (ILK), குவிய ஒட்டுதல் கைனேஸ் (FAK), டேலின், பாக்ஸிலின், பார்வின்கள், p130Cas, Src-குடும்ப கைனேஸ்கல் ரோ குடும்பத்தின் GTபேஸ்கள் போன்ற பல்வேறு வகையான அகவணு புரத கைனேஸ்கள் மற்றும் ஏற்பி மூலக்கூறுகள் வாயிலாக அடையப்படுகின்றது, சமிக்ஞை கடத்துகையை ஒருங்கிணைக்கும் முதன்மை புரதமாக ILK உள்ளது.[40] வலது பக்கத்தில் காட்டப்பட்டுள்ள மேலோட்டப்பார்வையைப் போன்று, ஒருங்கிணைந்த இண்டெகிரீன் மற்றும் வாங்கி தைரோசீன் கைனேஸ் சமிக்ஞை ஆகியவை அணு நிலைத்தன்மை, அபோப்டோசிஸ், பெருக்கம் மற்றும் வேறுபாடு ஆகியவற்றைக் கண்டறிகின்றன.
இரத்த ஓட்ட அணுக்களில் இண்டெகிரீன்-சமிக்ஞை மற்றும் சீதப்படல உயிரணுக்கள் போன்ற இரத்த ஓட்டமற்ற அணுக்களில் சமிக்ஞை ஆகியவற்றுக்கு இடையே முக்கிய வேறுபாடுகள் காணப்படுகின்றன. இரத்த ஓட்ட அணுக்களின் அணு மேற்பரப்பில் உள்ள இண்டெகிரீன்கள் இயல்பான உடலியல் குணங்கள் நிபந்தனைகளின் கீழ் செயலற்றுக் காணப்படுகின்றன. எடுத்துக்காட்டாக, சீதப்படல உயிரணு இணைப்பைத் தவிர்க்க இரத்த ஓட்ட இரத்த வெள்ளை அணுக்களில் அணு மேற்பரப்பு இண்டெகிரீன்கள் செயலற்ற நிலையில் பராமரிக்கப்படுகின்றன. சரியான தூண்டிக்கு மறுமொழியளிக்கும் பொருட்டே இரத்த வெள்ளையணு இண்டெகிரீன்கள் செயல்நிலை வடிவத்திற்கு மாற்றப்படுகின்றன, இது போன்றவை அழற்சி விளைவிக்கின்ற மறுமொழியின் தளத்தில் பெறப்பட்டன. இதே முறையில், இரத்த உறைவை தவிர்க்க இயல்பான சூழலில் இரத்த வட்டுக்களின் இரத்த ஓட்டத்தின் அணு மேற்பரப்பில் உள்ள இண்டெகிரீன்கள் செயலற்ற நிலையில் வைக்கப்பட்டிருப்பது முக்கியம். மாறாக, இயல்பான சூழலில் சீதப்படல உயிரணுக்கள் தங்களின் அணு புறப்பரப்பில் இண்டெகிரீன்களை செயல்நிலையில் வைத்துள்ளன, ஸ்ட்ரோமல் அணுக்களுக்கு அவற்றின் ஒட்டுதல் நிலையை நிலைநிறுத்த இவை உதவுகின்றன, இவை தங்களின் நிலைத்தன்மை மற்றும் வேறுபாட்டைப் பராமரிக்க நேர்த்தியான சமிக்ஞைகளை வழங்குகின்றன.[41]
டோல்-போன்ற வாங்கிகள்[தொகு]
செயலாக்கப்படும் போது, டோல்-போன்ற வாங்கிகள் (TLRகள்) ஒரு சமிக்ஞையை கடத்தும் பொருட்டு அணுக்களின் சைட்டோபிளாசத்தில் ஏற்பி மூலக்கூறுகளை அமர்த்துகின்றன. நான்கு ஏற்பி மூலக்கூறுகள் சமிக்ஞையில் ஈடுபடுவதாக அறியப்படுகின்றன. இந்த புரதங்கள் MyD88, டிராப் (மால் என்றும் அழைக்கப்படுகின்றது), ட்ரிப் மற்றும் ட்ராம் என்றும் அறியப்படுகின்றன.[42][43][44] இந்த ஏற்பிகள் சமிக்ஞையை பெருக்கமடையச் செய்யும் குறிப்பிட்ட புரத கைனேஸ்கள் (IRAK1, IRAK4, TBK1, மற்றும் IKKi) உள்ளிட்ட அணுக்களிலுள்ள பிர மூலக்கூறுகளை செயலாக்குகின்றன, மேலும் இறுதியாக அழற்சி மறுமொழியைத் திட்டமிடுகின்ற மரபணுக்களின் தூண்டுதலுக்கு அல்லது ஒடுக்கத்திற்கு வழிவகுக்கின்றன. அனைத்திலும், ஆயிரக்கணக்கான மரபணுக்கள் TLR சமிக்ஞையால் செயலாக்கப்பட்டுகின்றன, மேலும் TLRகள் மரபுப் பண்பேற்றத்திற்கான மிகவும் வலிமையான மற்றும் முக்கியமான முகப்புவழி ஒன்றையும் உருவாக்குகின்றது.
அணைவி-கட்டுப்படுத்தப்பட்ட அயனி வழி வாங்கிகள்[தொகு]
அணைவி-செயலாக்கப்பட்ட அவனி வழி யானது அதன் அணைவியை ஏற்றுக்கொள்கின்றது, பின்னர் அயனியால் கடக்க முடிந்த பிளாஸ்மா சவ்வில் இடைவெளியைத் (வழித்தடம்) திறக்கின்ற கட்டமைப்பு மாற்றத்திற்கு உட்படுகின்றது. இந்த அயனிகள் சமிக்ஞையை பின்னர் அனுப்பும். இந்த இயந்திர நுட்பத்திற்கான உதாரணம் ஏற்பி அணுவில் அல்லது நரம்பியல் நரம்பிணைப்பின் பின்-இணைவளைவு அணுவில் காணப்படுகின்றது.
முரண்பாடாக, பிற அயனி வழிகள் அணு சாத்தியக்கூறில் ஏற்படும் மாற்றத்திற்கு பதிலளிக்கும் பொருட்டு திறக்கின்றன, அதாவது சவ்வுக்கு இடையேயான மின்னூட்டத்தின் வேறுபாடு ஆகும். நியூரான்களில் இந்த உத்தியானது நரம்புகளில் பயணிக்கின்ற செயல்பாட்டு சாத்தியங்களில் உட்படுகின்றது. அணைவி-கட்டுப்படுத்தப்பட்ட அயனி வழிகளுக்கு பதிலளிக்கும் பொருட்டு நிகழ்கின்ற அயனிகளின் வருகை பெரும்பாலும் பின்-இணைவளைவு அணுக்களின் முனைவு நீக்குதல் சவ்வினால் உண்டாகும் செயல்பாட்டுச் சாத்தியங்களைத் தூண்டுகின்றது, இவை மின்னழுத்தம்-கட்டுப்படுத்தப்பட்ட அயனி வழிகளின் அலை போன்ற திறப்பை விளைவிக்கின்றது. மேலும், கால்சியம் அயனிகள் பொதுவாக அணைவி-தூண்டப்பட்ட அயனி வழித் திறத்தலின் போது அணுவில் அனுமதிக்கப்படுகின்றன. இந்த கால்சியம் பாரம்பரிய இரண்டாம் தூதுவராக செயல்படுகின்றது, இயக்க சமிக்ஞை கடத்துகையில் அமைக்கப்படுகின்றது மற்றும் மறுமொழியளிக்கும் அணுவின் அணு உடலியலை மாற்றுகின்றது. இது, நரம்பிணைப்பில் ஈடுபடுகின்ற கிளைகொள் முதுகுத்தண்டு மறுவடிவமைத்தல் வாயிலாக முன் மற்றும் பின் இணைவளைவு அணுக்களுக்கு இடையேயான நரம்பிணைப்பின் வலிமையாக்கத்தை விளைவிக்கலாம்.
அகவணு வாங்கிகள்[தொகு]
நியூக்ளியர் வாங்கிகள் மற்றும் சைட்டோபிளாஸ்மிக வாங்கிகள் உள்ளிட்டவை அகவணு வாங்கிகள் ஆகும், மேலும் அவை முறையே நியூக்ளியோபிளாஸமில் அல்லது சைட்டோபிளாஸமில் அமைந்த கரைபொருள் புரதங்களாக உள்ளன. நியூக்ளியர் வாங்கிகளுக்கான பொதுவான அணைவிகள் ஸ்டீராய்டு ஹார்மோன்கள் (எடுத்துக்காட்டாக, டெஸ்டோஸ்டரோன், புரோகஸ்டரோன் மற்றும் கார்ட்டிசல் ஆகியவை) மற்றும் வைட்டமின் A மற்றும் D அவற்றின் வழிபொருள்கள் ஆகியவற்றுடன் கொழுப்பு சார் ஹார்மோன்களாக உள்ளன. அதன் வாங்கியை அடையவும் சமிக்ஞை கடத்துகையைத் தொடங்கவும், ஹார்மோன் கண்டிப்பாக பிளாஸ்மா சவ்வின் வழியே கடக்க வேண்டும், வழக்கமாக குறைபாடான பரவலாக இருந்தது. நியூக்ளியர் வாங்கிகளானவை அணைவி-செயலாக்கப்பட்ட படியெடுத்தல் செயலாக்கிகளாக உள்ளன; அணைவியுடன் (ஹார்மோன்) கட்டுதலில், அணைவிகள் நியூக்ளியஸில் நியூக்ளியர் சவ்வின் வழியே கடந்து குறிப்பிட்ட மரபணுவின் படியெடுத்தலையும் மற்றும் புரதத்தின் உற்பத்தியையும் செயல்படுத்தும்.
ஹார்மோன்களால் செயலாக்கப்பட்ட நியூக்ளியர் வாங்கிகள் வாங்கி குறிப்பிட்ட ஹார்மோன்-பொறுப்பு உறுப்புகளில் (HREகள் ) DNA வில் இணைக்கப்பட்டுள்ளன, இவை ஹார்மோன் வாங்கி பிணைப்பால் செயலாக்கப்பட்டுள்ள மரபணுவின் வினையூக்கி மண்டலத்தில் அமைந்துள்ள DNA வரிசைகள் ஆகும். இது குறிப்பிட்ட மரபணுவின் படியெடுத்தலை இயக்குவதால், இந்த ஹார்மோன்கள் மரபணு வெளிப்பாட்டின் தூண்டிகள் என்றும் அழைக்கப்படுகின்றன. மரபணு படியெடுத்தலின் செயலாக்கமானது ஏற்கனவே உள்ள புரதங்களை நேரடியாகப் பாதிக்கின்ற சமிக்ஞைகளை விடவும் மிகவும் குறைந்த வேகமுடையது. பின்விளைவாக, நியூக்ளிக் வாங்கிகளைப் பயன்படுத்துகின்ற ஹார்மோன்களின் விளைவுகள் இயல்பாக நீண்டகாலமாக உள்ளன. இருப்பினும் இந்த கரையக்கூடிய வாங்கிகள் வாயிலான சமிக்ஞை கடத்துகையானது சில புரதங்களை மட்டுமே ஈடுபடுத்துகின்றன, மரபணு நெறிமுறைகளின் விவரங்கள் இன்னும் நன்றாக அறியப்படவில்லை. நியூக்ளிக் வாங்கிகள் அனைத்தும் ஒரே மாதிரியான மட்டுக் கட்டமைப்பைக் கொண்டுள்ளன, அவை:
- N-AAAABBBBCCCCDDDDEEEEFFFF-C
இங்கு, CCCC என்பது துத்தநாகம் விரல்களைக் கொண்டிருக்கும் DNA-கட்டப்பட்ட களமாகும், மேலும் EEEE என்பது அணைவி கட்டப்பட்ட களம். இரண்டாவது DNA கட்டுதலுக்கு முன்னதாக பெரும்பாலான நியூக்ளிய வாங்கிகளின் இருபடியாக்கலுக்கு பொறுப்பாகவும் உள்ளது. மூன்றாம் செயல்பாடாக, அது பரிமாற்ற உபகரணத்துடன் தொடர்புகொள்ளப் பயன்படுத்தப்படும் மாற்றுசெயலாக்கதிற்கு பொறுப்பேற்றுள்ள கட்டமைப்பு உறுப்புகளைக் கொண்டிருக்கின்றது. DNA-கட்டுதல் களத்தில் துத்தநாகம் விரல்கள் DNA வின் பாஸ்பேட் முதுகெலும்புடன் தொடர்பு வைத்திருப்பதால் DNA கட்டுதலை நிலைநிறுத்துகின்றது. வாங்கிகளுக்குப் பொருந்துகின்ற DNA வரிசைகள் வழக்கமாக இயல்பான, தலைகீழான அல்லது திருப்பப்பட்ட ஹெக்சாமெரிக் மீண்டும் திரும்புதல்களாக உள்ளன. அந்த வரிசைகள் சற்று ஒரேமாதிரியானவை, ஆனால் அவற்றின் வச அமைவு மற்றும் இடைவெளி ஆகியவை தனியெனக் கூறக்கூடிய வாங்கிகளின் DNA-கட்டுதல் களங்களின் துணை அலகுகளாக உள்ளன.
ஸ்டீராய்டு வாங்கிகள் நியூக்ளியர் வாங்கிகளின் துணைப்பிரிவுகளாக உள்ளன, இவை சைட்டோசலில் முதன்மையாக உள்ளன. ஸ்டீராய்டு ஹார்மோன்கள் இல்லாதபோது, வாங்கிகள் அபோரெசெப்டார் பிணைப்பு என்றழைக்கப்பட்ட பிழைப்பில் ஒன்றாக ஒட்டிக்கொள்கின்றன, மேலும் இவை சாபரொன் புரதங்களையும் கொண்டிருக்கின்றன (இவை வெப்ப அதிர்ச்சி புரதங்கள் அல்லது Hsp கள் என்றும் அழைக்கப்படுகின்றன). Hsp கள் நியூக்ளியஸ் அணுகக்கூடியதில் அதன் நடைப்பகுதியை இயக்குகின்ற சமிக்ஞை வரிசை போன்ற வழியில் மடிக்க புரதத்திற்கு உதவுதல் மூலமாக வாங்கியை செயலாக்குவது அவசியம்.
மரபணு வெளிப்பாட்டில் ஸ்டீராய்டு வாங்கிகள் கட்டுப்படுத்தப்பட்ட விளைவையும் கொண்டிருக்கலாம், அவற்றின் மாற்றுசெயலாக்க களம் மறைந்திருப்பதால் அது மாற்றத்தைச் செயலாக்க முடியாது. மேலும், ஸ்டீராய்டு வாங்கிகள் நடவடிக்கையானது செரீன் எச்சங்களின் N-முனையில் அவற்றின் பாஸ்போரைலேசன் மூலமாக மேம்படுத்தப்படலாம். அதன் விளைவு மற்றொரு சமிக்ஞை கடத்துகை வழித்தடத்தை உண்டாக்குகின்றது, எடுத்துக்காட்டாக வளர்ச்சிக் காரணியை கூறலாம். இந்த செய்கையானது குறுக்கீடு (crosstalk) என்று அழைக்கப்படுகின்றது.
RXR-வாங்கிகள் மற்றும் ஆர்பன்-வாங்கிகள் ஆகிய நியூக்ளியர் வாங்கிகளை பின்வருவனவற்றால் செயலாக்க முடியும்
- பரவல் வாயிலாக அணுவில் நுழைந்த மரபு நாளமில்லா-தொகுப்பு ஹார்மோன்
- அணுவில் முன்னோடி அல்லது புரோஹார்மோன் என்பதிலிருந்து (உதாரணமாக, விழித்திரை) கட்டமைக்கப்பட்ட ஹார்மோன், இவற்றை இரத்த ஓட்டம் வாயிலாக அணுவிற்குக் கொண்டுவர முடியும்
- அணுவில் முழுவதுமாக தொகுக்கப்பட்ட ஹார்மோன், உதாரணமாக இரத்த அழுத்தக்குறைப்பி.
இந்த வாங்கிகள் நியூக்ளியஸில் இடம்பெற்றுள்ளன. இவை சாபெரோன் புரதங்களுடன் உடன்செல்வதாக இல்லை . ஹார்மோன்கள் இல்லாத போது, இந்த வாங்கிகள் மரபணுவைக் குறிக்கின்ற தங்களின் குறிப்பிட்ட DNA வரிசையைக் கட்டுகின்றன. ஹார்மோன் மூலமான செயலாக்கத்தில், அவை கட்டுப்படுத்தபட்ட மரபணுவின் மாற்றத்தை செயல்படுத்துகின்றது.
நோய் எதிர்ப்பு மண்டலத்தின் குறிப்பிட்ட அகவணு வாங்கிகள் சைட்டோபிளாஸ்மிக வாங்கிகளின் எடுத்துக்காட்டுகளாக உள்ளன. சமீபத்தில் அடையாளம் காணப்பட்ட NOD ஒத்த வாங்கிகள் (NLRகள்) குறிப்பிட்ட எகாரியோடிக் அணுக்களின் சைட்டோபிளாசத்தில் தங்குகின்றன. இவை TLRகள் என்ப்படும் புறவணு வாங்கிகளின் அணைவி-கட்டுதல் உட்கருவினை ஒத்த லூசின்-உயர் திருப்ப (LRR) உட்கருவைப் பயன்படுத்தி நுண்ணுயிரி மூலக்கூறுகள் போன்ற குறிப்பிட்ட அணைவிகளுடன் தொடர்புகொள்கின்றன. இந்த மூலக்கூறுகளில் பல (எ.கா., NOD1 மற்றும் NOD2) NF-κB சமிக்ஞையை செயலாக்குகின்ற RICK கைனேஸ் (அல்லது RIP2 கைனேஸ்) என்று அழைக்கப்படும் என்சைம்களுடன் தொடர்புகொள்கின்றன. மறுபுறம் மற்றவை (எ.கா., NALP3) அழற்சி ஏற்படுத்தும் கேஸ்பேஸ்களுடன் (எ.கா., கேஸ்பேஸ் 1) தொடர்புகொள்கின்றன. மேலும் அவை குறிப்பிட்ட சைட்டோகீன்களின் (எ.கா., இண்டர்லுக்கின்-1β) செயலாக்கத்தைத் தொடங்குகின்றன.[45] இதேபோன்ற வாங்கிகள் தாவர அணுக்களின் உள்ளும் காணப்படுகின்றன, இவை தாவர R புரதங்கள் (Plant R Proteins) என்று அழைக்கப்படுகின்றன. சைட்டோபிளாஸ்மா வாங்கிகளின் மற்றொரு வகையும் நோய் எதிர்ப்பு கண்காணிப்பில் பங்குவகிக்கின்றன. இந்த வாங்கிகள் RNA ஹெலிகேசஸ் எனப்படுகின்றன, இவை RIG-I, MDA5 மற்றும் LGP2 என்பவற்றைக் கொண்டுள்ளன.[46]
இரண்டாம் தூதுவர்கள்[தொகு]
அகவணு சமிக்ஞை கடத்துகை பெருமளவில் இரண்டாம் தூதுவர் மூலக்கூறுகளால் கொண்டு செல்லப்படுகின்றன.
கால்சியம்[தொகு]
Ca2+ செறிவானது வழக்கமாக மென்மையான அகச்சோற்றுவலை மற்றும் மணியிழையம் ஆகியவற்றில் தனிமைப்படுத்தல் வாயிலாக சைட்டோஸாலில் மிகவும் குறைந்த நிலையில் பராமரிக்கப்படுகின்றது. சைட்டோஸாலில் அகச்சோற்றுவலையிலிருந்து வெளிவரும் Ca2+ பின்னர் செயலாக்கப்படுகின்ற சமிக்ஞை புரதங்களுக்கு வெளியிடப்பட்ட Ca2+ கட்டுப்படுத்துகின்றது. Ca2+ இன் போக்குவரத்தை கட்டுப்படுத்தும் பணியினை நிகழ்த்தும் இரண்டு இணைக்கப்பட்ட வாங்கி/அயனி வழி புரதங்கள் உள்ளன, அவை:
- InsP3-வாங்கி யானது அதன் சைட்டோசோலிக் பக்கத்தில் இனோசிட்டால் டிரைபாஸ்பேட் (பெயரானது) உடனான ஊடாடலில் Ca2+ ஐ நகர்த்தும். இது நான்கு தனித்தன்மையான துணையலகுகளைக் கொண்டுள்ளன.
- ரியானோடின் வாங்கி யானது ஆல்க்கலாய்டு தாவரத்திற்கு பின்னர் ரியானோடின் என்று பெயரிடப்பட்டது. இது InsP3 வாங்கியை போன்றே அதன் சைட்டோசோலிக் பக்கத்தில் ஏற்றுக்கொள்ளப்படுகின்ற Ca2+ மூலமாக சைட்டோசலில் Ca2+ ஐ நகர்த்துவதற்கு தூண்டுகின்றது , எனவே பின்னூட்ட இயந்திர நுட்பத்தை நிறுவுகின்றது; வாங்கிகளின் அருகில் சைட்டோசாலில் குறைந்த எண்ணிக்கையிலான Ca2+ அதிகமான Ca2+ வை வெளியிடும். இது குறிப்பாக நியூரான்கள் மற்றும் தசை அணுக்கள் ஆகியவற்றில் முக்கியமானதாக உள்ளது. இதயம் மற்றும் கணையம் ஆகியவற்றின் அணுக்களில், மற்றொரு இரண்டாம் தூதுவரானது (சுழற்சி-ADP ரைபோஸ்) வாங்கி செயல்படுத்துதலில் பங்கெடுத்துக் கொள்கின்றது. சைட்டோசாலில் Ca2+ வின் குறிப்பிட்ட நிலை மற்றும் நேரம்-கட்டுப்படுத்தப்பட்ட செயல்பாடு Ca2+ அலை என்றும் அழைக்கப்படுகின்றது. அகவணு சேமிப்புகளில் அல்லது புறவணு ஆதாரங்களில் இருந்து சைட்டோசலில் வெளியிடப்பட்டால், Ca2+ ஆனது அணுவில் சமிக்ஞை மூலக்கூறாகச் செயல்படுகின்றது. இது, Ca2+ கட்டுப்பாடின்றி (மற்றும் செயல்நிலையில்) இருக்கும்போது வரையறுக்கப்பட்ட நேரம் மற்றும் இடைவெளி ஆகியவற்றின் மூலமாகச் செயல்படுகின்றது. ஆகவே, அணுவினுள் கட்டுப்பாடற்ற Ca2+ வழக்கமாக தாழ்வாகவே இருக்கின்றது; இது ஆர்கனல்களில் சேமிக்கப்படுகின்றது, இயல்பாக இது அகச்சோற்றுவலையில் (தசை அணுக்களில் உள்ள தசையுரு வலைப்பின்னல் இரைப்பை) கல்ரெடிகுலின் போன்ற மூலக்கூறுகளுக்கு கட்டுண்டுள்ளது.
Ca2+ பல்வேறு செயலாக்கங்களில் பயன்படுத்தப்படுகின்றது, தசை சுருக்கம், நரம்பு முனைகளிலிருந்து நரம்பியல்கடத்துகையினை வெளியிடுதல், விழித்திரை அணுக்களில் பார்வை, பெருக்கம், சுரப்பு, செல்சட்டக மேலாண்மை, அணு பெயர்ப்பு, மரபணு வெளிப்பாடு மற்றும் வளர்சிதை மாற்றம் ஆகியவை அவற்றில் அடங்கும். Ca2+ செயலாக்கத்திற்கு வழிவகுக்கும் மூன்று முக்கிய வழித்தடங்களாவன:
- G புரத-நெறிமுறைப்படுத்தப்பட்ட வழித்தடங்கள்
- வாங்கி-தைரோசின் கைனேஸ்களால் நெறிப்படுத்தப்பட்ட வழித்தடங்கள்
- அணைவி அல்லது தற்போது நெறிமுறைப்படுத்தப்பட்ட அயன் வழிகள்
புரதங்களை Ca2+ நெறிமுறைப்படுத்துவதற்கு உள்ள இரண்டு வேறுபட்ட வழிகளாவன:
- புரதங்கள் வாயிலான Ca2+ வின் நேரடி ஏற்பு
- என்சைமின் செயல்பாட்டு தளத்தில் Ca2+ வின் கட்டுதல்.
புரதத்துடனான Ca2+ வின் சிறந்த ஆய்வுக்கு உட்படுத்தப்பட்ட தொடர்புகளில் ஒன்றானது Ca2+ மூலமான கால்மாடுலின் (calmodulin) நெறிப்படுத்துதல் ஆகும். கால்மாடுலின் (calmodulin) அதனூடே பிற புரதங்களை அல்லது பெரிய புரதங்களின் பகுதியாக இருப்பதை (உதாரணமாக, பாஸ்போரைலேஸ் கைனேஸ்) நெறிப்படுத்துகின்றது. Ca2+/கால்மாடுலின் பிணைப்பானது பெருக்கம், செல்பிரிவு மற்றும் நரம்பியல் சமிக்ஞை கடத்துகை ஆகியவற்றில் முக்கியப் பங்குவகிக்கின்றது.
கொழுப்பு விரும்பி[தொகு]
கொழுப்பு விரும்பி இரண்டாம் தூதுவர் மூலக்கூறுகளானது அணுச் சவ்வுகளில் இயல்பாக தங்கியுள்ள கொழுப்புகளிலிருந்து பெறப்படுகின்றன. செயலாக்கப்பட்ட வாங்கிகளால் தூண்டப்பட்ட என்சைம்கள் கொழுப்புகளை மாற்றியமைத்து, அவற்றை இரண்டாம் தூதுவர்களாக மாற்றுகின்றன.
டையசைல்கிளைசரால் என்பது கொழுப்பு விரும்பி இரண்டாம் தூதுவராகும், இது புரத கைனேஸ் C செயலாக்கத்திற்கு அவசியமானது. செராமைடு, எயிக்கோசனாய்டுகள் மற்றும் லைசோபாஸ்பேட்டிடிக் அமிலம் ஆகியவையும் கொழுப்பு விரும்பி இரண்டாம் தூதுவர்களாகின்றன.
நைட்ரிக் ஆக்சைடு[தொகு]
நைட்ரிக் ஆக்ஸைடு (NO) இரண்டாம் தூதுவராகவும் செயல்பட முடியும். நைட்ரிக் ஆக்ஸைடு வாயு பிளாஸ்மா சவ்வின் வழியே பரவுகின்ற கட்டுப்பாடற்ற உறுப்பாக உள்ளது. துணை விளைபொருளாக சிட்ருலீன் உடன் NO சிந்தேஸ் என்சைம் மூலம் ஆர்க்கினின் மற்றும் ஆக்சிஜன் ஆகியவற்றிலிருந்து NO உருவாக்கப்படுகின்றது. NO ஆனது கரைக்கக்கூடிய குனைலேட் சைக்ளஸ் என்சைம் என்ற அதன் இலக்கு வாங்கியின் செயலாக்கத்தின் வாயிலாக முதன்மையாகச் செயல்படுகின்றது, அப்போது இது செயலாக்கப்பட்டு இரண்டாம் வாங்கி சுழற்சி-குயனோசைன் ஒற்றை பாஸ்பேட்டை (cGMP) உருவாக்குகின்றது. NO புரதங்களின் சக இணைப்பு மாற்றம் அல்லது அவற்றின் உலோக துணைக்காரணிகள் வாயிலாகவும் செயல்பட முடியும். இந்த மாற்றங்களில் பல மீளக்கூடியதாகவும் மற்றும் ரெடாக்ஸ் உத்தியின் மூலமாக செயல்படுவதாகவும் உள்ளன. NO நச்சுத்தன்மையில் அதிகச் செறிவுகளுடன் உள்ளது, அது தாக்கத்தால் விளைந்த பாதிப்புகளை விளைவிப்பதாகவும் கருதப்படுகின்றது.
NO பல செயல்பாடுகளில் பங்கேற்கின்றது. அவற்றில், இரத்தக் குழாய்களின் தளர்வு; நரம்பியக் கடத்திகள் அணுக்களின் கழிவுப் பொருள் நெறிமுறை; அணு நோய் எதிர்ப்பு மறுமொழி; தலைமுடி சுழற்சியின் பண்பேற்றம்; ஆண்குறி விறைப்புகளின் தயாரிப்பு மற்றும் பராமரிப்பு; H2AX பாஸ்போரைலேஷனுக்கு வழிவகுக்கும் சமிக்ஞைகளை தொடங்குவதன் மூலம் அபோப்டோசிஸின் செயலாக்கம் போன்றவை அடங்கும்.
முக்கிய வழித்தட உதாரணங்கள்[தொகு]
- cAMP சார்பு வழித்தடம் : மனிதர்களில், cAMP ஆனது புரத கைனேஸ் A வை (PKA, cAMP-சார்பு புரத கைனேஸ்) (படத்தைக் காண்க) செயலாக்குவதன் மூலமாகச் செயல்படுகின்றது, எனவே மேலும் விளைவுகள் முக்கியமாக cAMP-சார்பு புரத கைனேஸ் அடிப்படையிலானவை, இவை அணுவின் வகையின் அடிப்படையில் வேறுபடுகின்றன.
- MAPK/ERK வழித்தடம் : இது அணு மேற்பரப்பு வாங்கிகளுக்கு வளர்ச்சி காரணிகளைக் கட்டுதலுக்கான அகவணு மறுமொழிகளை இணைக்கின்ற வழித்தடம். இந்த வழித்தடம் மிகவும் சிக்கலானதாகவும் மற்றும் பல்வேறு புரத கூறுகளைக் கொண்டதாகவும் உள்ளது [47]. அடிப்படை வழித்தடம் வரைபடத்தில் காட்டப்பட்டுள்ளது (வலது புறம்), மேலும் வழித்தடத்தின் முக்கிய கூறுகள் கீழே வரையறுக்கப்பட்டுள்ளன. பல அணு வகைகளில், இந்த வழித்தடத்தின் செயலாக்கம் செல் பகுப்பை அளிக்கின்றது.
- IP3/DAG வழித்தடம்|IP3/DAG வழித்தடம் : PLC ஆனது பாஸ்போலிபிட் பாஸ்பேடிடைலினோசிட்டால் 4, 5-பைஸ்பாஸ்பேட் (PIP2) என்பதனைப் பிளந்து டையாசைல் கிளைசரால் (DAG) மற்றும் இனோசிட்டால் 1,4,5-டிரைபாஸ்பேட் (IP3) என்பனவற்றை விளைவிக்கின்றது. DAG ஆனது சவ்விற்குக் கட்டுண்டுள்ளது, மேலும் IP3 ஆனது சைட்டோசோலில் கரையக்கூடிய கட்டமைப்பாக வெளியிடப்படுகின்றது. பின்னர் IP3 ஆனது குறிப்பாக அகச்சோற்றுவலையில் (ER) கால்சியம் வழிகளில் IP3 வாங்கிகளைக் கட்ட சைட்டோசல் வழியாக பரவுகின்றது|IP3 வாங்கிகளைக் கட்ட சைட்டோசல் வழியாக பரவுகின்றது. இந்த வழிகள் குறிப்பாக கால்சியத்திற்கு மட்டுமானது, மேலும் இதன் வழியே கால்சியத்தின் வழிப்பொருட்கள் மட்டுமே கடந்துசெல்ல அனுமதிக்கின்றது. இது அகவணு மாற்றங்கள் மற்றும் நடவடிக்கை ஆகியவற்றின் அடுக்கை விளைவிப்பதை அதிகரிக்க கால்சியத்தின் சைட்டோசோலிக் செறிவை விளைவிக்கின்றது.[48] மேலும், கால்சியம் மற்றும் DAG ஆகியவை இணைந்து PKC செயலாக்கப் பணிபுரிகின்றன, இது அணு நடவடிக்கையை மாற்ற முனையும் பிற மூலக்கூறு பாஸ்பேரைலேட்டில் செல்கின்றது. சுவை, உளச் சோர்வு, கட்டி ஊக்குவிப்பு இன்னும் பல உள்ளிட்டவை இறுதி விளைவுகள் ஆகின்றன.[48]
குறிப்புதவிகள்[தொகு]
- ↑ Rensing, L. (1972). "Periodic geophysical and biological signals as Zeitgeber and exogenous inducers in animal organisms". Int. J. Biometeorol. 16: Suppl:113–125. பப்மெட்:4621276.
- ↑ Tonndorf J. (1975). "Davis-1961 revisited. Signal transmission in the cochlear hair cell-nerve junction". Arch. Otolaryngol. 101 (9): 528–535. பப்மெட்:169771.
- ↑ Ashcroft SJ, Crossley JR, Crossley PC. (1976). "The effect of N-acylglucosamines on the biosynthesis and secretion of insulin in the rat". Biochem. J. 154 (3): 701–707. பப்மெட்:782447.
- ↑ Hildebrand E. (1977). "What does Halobacterium tell us about photoreception?". Biophys. Struct. Mech. 3 (1): 69–77. doi:10.1007/BF00536457. பப்மெட்:857951.
- ↑ Kenny JJ, Martinez-Maza O. et al (1979). "Lipid synthesis: an indicator of antigen-induced signal transduction in antigen-binding cells". J. Immunol. 112 (4): 1278–1284. பப்மெட்:376714.
- ↑ Gomperts, BD.; Kramer, IM. Tatham, PER. (2002). Signal transduction. Academic Press. பன்னாட்டுத் தரப்புத்தக எண்:0-12-289631-9. https://archive.org/details/signaltransducti0000gomp_a4u3.
- ↑ 7.0 7.1 Rodbell, M. (1980). "The role of hormone receptors and GTP-regulatory proteins in membrane transduction". Nature 284 (5751): 17–22. doi:10.1038/284017a0. பப்மெட்:6101906.
- ↑ Beato M, Chavez S and Truss M (1996). "Transcriptional regulation by steroid hormones". Steroids 61 (4): 240–251. doi:10.1016/0039-128X(96)00030-X. பப்மெட்:8733009. https://archive.org/details/sim_steroids_1996-04_61_4/page/240.
- ↑ Hammes SR (2003). "The further redefining of steroid-mediated signaling". Proc Natl Acad Sci USA 100 (5): 21680–2170. doi:10.1073/pnas.0530224100. பப்மெட்:12606724.
- ↑ Sugden D, Davidson K. et al. (2004). "Melatonin, melatonin receptors and melanophores: a moving story". Pigment Cell Res. 17 (5): 454–460. doi:10.1111/j.1600-0749.2004.00185.x. பப்மெட்:15357831.
- ↑ 11.0 11.1 Carpenter G, and Cohen S. (1990). "Epidermal growth factor". J. Biol. Chem. 265 (14): 7709–7712. பப்மெட்:2186024.
- ↑ 12.0 12.1 வார்டு எம் மற்றும் மார்சே, டி. [1][2] 2007-03-06 அன்று பெறப்பட்டது
- ↑ Schroder et al. (2004). "Interferon-γ an overview of signals, mechanisms and functions". Journal of Leukocyte Biology 75: 163–189. doi:10.1189/jlb.0603252. பப்மெட்:14525967. http://www.jleukbio.org/cgi/content/full/75/2/163. பார்த்த நாள்: 2010-05-14.
- ↑ Chung CW, Cooke RM et al. (1995). "The three-dimensional solution structure of RANTES". Biochemistry 34 (29): 9307–9314. doi:10.1021/bi00029a005. பப்மெட்:7542919.
- ↑ 15.0 15.1 Kistler J, Stroud RM et al. (1982). "Structure and function of an acetylcholine receptor". Biophys. J. 37 (1): 371–383. doi:10.1016/S0006-3495(82)84685-7. பப்மெட்:7055628. https://archive.org/details/sim_biophysical-journal_1982-01_37_1/page/371.
- ↑ Wiesmann, C. and de Vos, AM. (2001). "Nerve growth factor: structure and function". Cell Mol Life Sci 58 (5-6): 748–759. doi:10.1007/PL00000898. பப்மெட்:11437236. https://archive.org/details/sim_cellular-and-molecular-life-sciences_2001-05_58_5-6/page/748.
- ↑ Goldstein, A. (1976). "Opioid peptides endorphins in pituitary and brain". Science 193 (4258): 1081–1086. doi:10.1126/science.959823. பப்மெட்:959823.
- ↑ Kroeze WK, Kristiansen K, and Roth BL. (2002). "Molecular biology of serotonin receptors, structure and function at the molecular level". Curr Top Med Chem 2 (6): 507–528. doi:10.2174/1568026023393796. பப்மெட்:12052191.
- ↑ Missale C, Nash SR. et al (1998). "Dopamine receptors:from structure to function". Physiol. Rev. 78 (1): 189–225. பப்மெட்:9457173. https://archive.org/details/sim_physiological-reviews_1998-01_78_1/page/189.
- ↑ Adams TE, Epa, VC et al (2000). "Structure and function of the type 1 insulin-like growth factor receptor". Cell Mol Life Sci 57 (7): 1050–1093. doi:10.1007/PL00000744. பப்மெட்:10961344. https://archive.org/details/sim_cellular-and-molecular-life-sciences_2000-07_57_7/page/1050.
- ↑ Roy AK and Chatterjee B. (1995). "Androgen action". Crit Rev Eukaryot Gene Expr. 5 (2): 157–176. பப்மெட்:8845582.
- ↑ Small KM, McGraw DW and Liggett SB. (2003). "Pharmacology and physiology of human adrenergic receptor polymorphisms". Annu Rev Pharmacol Toxicol 43: 381–411. doi:10.1146/annurev.pharmtox.43.100901.135823. பப்மெட்:12540746. https://archive.org/details/sim_annual-review-of-pharmacology-and-toxicology_2003_43/page/381.
- ↑ Burns ME and Arshavsky VY. (2005). "Beyond counting photons: trials and trends in vertebrate visual transduction". Neuron 48 (3): 387–401. doi:10.1016/j.neuron.2005.10.014. பப்மெட்:16269358.
- ↑ Ronnett GV and Moon C. (2002). "G proteins and olfactory signal transduction". Annu Rev Physiol 64: 189–222. doi:10.1146/annurev.physiol.64.082701.102219. பப்மெட்:11826268. https://archive.org/details/sim_annual-review-of-physiology_2002_64/page/189.
- ↑ Wong GT, Gannon KS and Margolskee RF. (1996). "Transduction of bitter and sweet taste by gustducin". Nature 381 (6585): 796–800. doi:10.1038/381796a0. பப்மெட்:8657284.
- ↑ Hanna MH, Nowicki JJ and Fatone MA (1984). "Extracellular cyclic AMP (cAMP) during development of the cellular slime mold Polysphondylium violaceum: comparison of accumulation in the wild type and an aggregation-defective mutant". J Bacteriol 157 (2): 345–349. பப்மெட்:215252. https://archive.org/details/sim_journal-of-bacteriology_1984-02_157_2/page/345.
- ↑ Sprague GF Jr. (1991). "Signal transduction in yeast mating: receptors, transcription factors, and the kinase connection". Trends Genet 7 (11-12): 393–398. doi:10.1016/0168-9525(91)90218-F. பப்மெட்:1668192.
- ↑ Lalli E and Sassone-Corsi P (1994). "Signal transduction and gene regulation: the nuclear response to cAMP". J Biol Chem 269 (26): 17359–17362. பப்மெட்:8021233.
- ↑ 29.0 29.1 Rosen O (1987). "After insulin binds". Science 237 (4821): 1452–1458. doi:10.1126/science.2442814. பப்மெட்:2442814.
- ↑ Guo D, Jia Q. et al (1995). "Vascular endothelial cell growth factor promotes tyrosine phosphorylation of mediators of signal transduction that contain SH2 domains. Association with endothelial cell proliferation". J Biol Chem 270 (12): 6729–6733. doi:10.1074/jbc.270.12.6729. பப்மெட்:7896817.
- ↑ Bornfeldt KE, Raines EW. et al. (1995). "Platelet-derived growth factor. Distinct signal transduction pathways associated with migration versus proliferation.". Ann N Y Acad Sci 766: 416–430. doi:10.1111/j.1749-6632.1995.tb26691.x. பப்மெட்:7486687.
- ↑ Massague J and Gomis RR (2006). "The logic of TGFbeta signaling". FEBS Lett 580 (12): 2811–2820. doi:10.1016/j.febslet.2006.04.033. பப்மெட்:16678165.
- ↑ Johansson S. Svineng G et al. (1997). "Fibronectin-integrin interactions". Front. Biosci 2: d126–146. பப்மெட்:9159220.
- ↑ Jeremy M. Berg, John L. Tymoczko, Lubert Stryer; Web content by Neil D. Clarke (2002). Biochemistry. San Francisco: W.H. Freeman. பன்னாட்டுத் தரப்புத்தக எண்:0-7167-4954-8.
- ↑ Yang W, Xia S (2006). "Mechanisms of regulation and function of G-protein-coupled receptor kinases". World J Gastroenterol 12 (48): 7753–7. பப்மெட்:17203515.
- ↑ Burger M, Burger, JA et al (1999). "Point mutation causing constitutive signaling of CXCR2 leads to transforming activity similar to Kaposi's sarcoma herpesvirus-G protein-coupled receptor". J. Immunol. 163 (4): 2017–2022. பப்மெட்:10438939.
- ↑ 37.0 37.1 Li E, Hristova K (2006). "Role of receptor tyrosine kinase transmembrane domains in cell signaling and human pathologies". Biochemistry 45 (20): 6241–51. doi:10.1021/bi060609y. பப்மெட்:16700535.
- ↑ Schlessinger, J. (1988). "Signal transduction by allosteric receptor oligomerization.". Trends Biochem Sci 13 (11): 443–7. doi:10.1016/0968-0004(88)90219-8. பப்மெட்:3075366. http://www.ncbi.nlm.nih.gov/sites/entrez?db=pubmed&uid=3075366&cmd=showdetailview&indexed=google. பார்த்த நாள்: 2007-11-24.
- ↑ Roskoski, R, Jr. (2004). "The ErbB/HER receptor protein-tyrosine kinases and cancer". Biochem. Biophys. Res. Commun. 319 (1): 1–11. doi:10.1016/j.bbrc.2004.04.150. பப்மெட்:15158434.
- ↑ "Signalling via integrins: implications for cell survival and anticancer strategies". Biochimica et Biophysica Acta (BBA) - Reviews on Cancer 1775 (1): 163–80. January 2007. doi:10.1016/j.bbcan.2006.09.001. பப்மெட்:17084981.
- ↑ Gilcrease MZ. (2006). "Integrin signaling in epithelial cells". Cancer Lett. 247 (1): 1–25. doi:10.1016/j.canlet.2006.03.031. பப்மெட்:16725254.
- ↑ Yamamoto M, Sato S, Hemmi H, Hoshino K, Kaisho T, Sanjo H, Takeuchi O, Sugiyama M, Okabe M, Takeda K, Akira S (2003). "Role of adaptor TRIF in the MyD88-independent toll-like receptor signaling pathway". Science 301 (5633): 640–3. doi:10.1016/j.canlet.2006.03.031. பப்மெட்:12855817.
- ↑ Yamamoto M, Sato S, Hemmi H, Uematsu S, Hoshino K, Kaisho T, Takeuchi O, Takeda K, Akira S (2003). "TRAM is specifically involved in the Toll-like receptor 4-mediated MyD88-independent signaling pathway". Nat Immunol 4 (11): 1144–50. doi:10.1016/j.canlet.2006.03.031. பப்மெட்:14556004.
- ↑ Yamamoto M, Sato S, Hemmi H, Sanjo H, Uematsu S, Kaisho T, Hoshino K, Takeuchi O, Kobayashi M, Fujita T, Takeda K, Akira S (2002). "Essential role for TIRAP in activation of the signalling cascade shared by TLR2 and TLR4". Nature 420 (6913): 324–9. doi:10.1016/j.canlet.2006.03.031. பப்மெட்:12447441.
- ↑ Delbridge L, O'Riordan M (2007). "Innate recognition of intracellular bacteria". Curr Opin Immunol 19 (1): 10–6. doi:10.1016/j.coi.2006.11.005. பப்மெட்:17126540.
- ↑ Fujita T, Onoguchi K, Onomoto K, Hirai R, Yoneyama M. "Triggering antiviral response by RIG-I-related RNA helicases". Biochimie. doi:10.1016/j.canlet.2006.03.031. பப்மெட்:17379377.
- ↑ Orton RJ, Sturm OE, Vyshemirsky V, Calder M, Gilbert DR, Kolch W (Dec 2005). "Computational modelling of the receptor-tyrosine-kinase-activated MAPK pathway". The Biochemical journal 392 (Pt 2): 249–61. doi:10.1042/BJ20050908. பப்மெட்:16293107.
- ↑ 48.0 48.1 Alberts B, Lewis J, Raff M, Roberts K, Walter P (2002). Molecular biology of the cell (4th Edition ). New York: Garland Science. பன்னாட்டுத் தரப்புத்தக எண்:0-8153-3218-1.
மேலும் படிக்க[தொகு]
- தொழில்நுட்பமின்றி
- காஸ்மா ஷாலிசி'ஸ் "சிக்னல் டிரான்ஸ்டக்சன்" நோட்புக் ப்ரம் 2003-01-20 யூஸ்டு அண்டர் த GFDL வித் பெர்மிசன்
- வெர்னர் ஆர். லாவென்ஸ்டெயின், தி டச்ச்டோன் ஆப் லைப்: மாலிகுலார் இன்பர்மேஷன், செல் கம்யூனிகேஷன், அண்ட் த பவுண்டேஷன்ஸ் ஆப் லைப் , ஆக்ஸ்போர்டு யுனிவர்சிட்டி பிரஸ், 1999, ISBN 0-19-514057-5
- தொழில்நுட்பம்
- கோம்பர்ட்ஸ், கிராமர், தத்தம், "சிக்னல் டிரான்ஸ்டக்சன்", AP/எல்சேவியர் [2002], ISBN 0-12-289631-9. குறிப்பு நூல், மேலும் தகவலுக்கு: http://www.cellbiol.net .
- கெர்ஹார்டு கிராஸ், பயோகெமிஸ்டரி ஆப் சிக்னல் டிரான்ஸ்டக்சன் அண்ட் ரெகுலேஷன் , வைலே-VCH, 1999, ISBN 3-527-30378-2
- ஜான் டி. ஹான்காக், செல் சிக்னலிங் , அடிசன்-வெஸ்லே, 1998 ISBN 0-582-31267-1
புற இணைப்புகள்[தொகு]
- நெட்பாத் - எ குரேடேட் ரிசோர்ஸ் ஆப் சிக்னல் டிரான்ஸ்டக்சன் பாத்வேஸ் இன் ஹூமன்ஸ் பரணிடப்பட்டது 2012-09-20 at the வந்தவழி இயந்திரம்
- சிக்னல் டிரான்ஸ்டக்சன் - த விர்ச்சுவல் லைப்ரரி ஆப் பயோகெமிஸ்டரி அண்ட் செல் பயாலஜி பரணிடப்பட்டது 2010-10-31 at the வந்தவழி இயந்திரம்
- TRANSPATH(R) பரணிடப்பட்டது 2006-02-18 at the வந்தவழி இயந்திரம் - எ டேட்டாபேஸ் அபௌட் சிக்னல் டிரான்ஸ்டக்சன் பாத்வேஸ்
- சயின்ஸ்சஸ் STKE - சிக்னல் டிரான்ஸ்டக்சன் நாலேட்ஜ் என்விரான்மெண்ட் , ப்ரம் த ஜேர்னல் சயின்ஸ், வெளியிட்டது AAAS.
- UCSD-நேச்சர் சிக்னலிங் கேட்வே பரணிடப்பட்டது 2013-02-12 at the வந்தவழி இயந்திரம் - நேச்சர் பப்ளிஷிங் குரூப்
- லிட்லைன்ஸ்பெக்டர் பரணிடப்பட்டது 2019-05-11 at the வந்தவழி இயந்திரம் - சிக்னல் டிரான்ஸ்டக்சன் பாத்வே மைனிங் இன் பப்மெட் அப்ஸ்ட்ராக்ட்ஸ்
- ஹூயாக்ஸியன் சென், எட் ஆல். எ செல் பேஸ்டு இம்முனோசைட்டோகெமிக்கல் ஆஸ்ஸே பார் மானிட்டரிங் கினாஸ் சிக்னலிங் பாத்வேஸ் அண்ட் டிரக் எபிகேசி (PDF) பரணிடப்பட்டது 2012-02-22 at the வந்தவழி இயந்திரம் அனலிட்டிகல் பயோகெமிஸ்டரி 338 (2005) 136-142


