கரிம வேதியியல்
இந்தக் கட்டுரையில் மேற்கோள்கள் அல்லது உசாத்துணைகள் எதுவும் இல்லை. |
கரிம வேதியியல் அல்லது சேதன இரசாயனம் (Organic Chemistry), என்பது வேதியியலின் ஒரு துணைப் பகுதியாகும். இது கரிம (Carbon) அணுக்கள் மற்றும் கரிம சேர்மங்கள் ஆகியவற்றால் ஆன வேதிப்பொருட்களின் அமைப்பு, இயல்புகள், வேதிவினைகள் பற்றிய இயல் ஆகும். நன்கு அறியப்பட்ட கரிமப் பொருள் மரக்கரி ஆகும். அச்சொல்லில் இருந்து கரிம வேதியியல் என்ற சொல் பாவனைக்கு[1] (பயன்பாட்டிற்கு) வந்துள்ளது.
கரிம வேதிப்பொருட்களின் அமைப்பு பற்றிய கல்வியானது நிறமாலையியலை பயன்படுத்தி இயற்பியல் மற்றும் வேதியியல் வழிமுறைகள் மூலம் கரிம சேர்மங்கள் மற்றும் கரிம வேதிப்பொருட்களின் கூட்டமைவு மற்றும் ஆக்க அமைவு ஆகியனவற்றை கண்டறிதலையும் உள்ளடக்கியதாகும். கரிம வேதிப்பொருட்களின் இயல்புகள் பற்றிய கல்வியானது தூய்மையான நிலை, திரவ நிலை, கலவை நிலை மற்றும் தோற்ற நிலைகளிலுள்ள கரிம வேதிப்பொருட்களின் இயற்பியல் மற்றும் வேதியியல் பண்புகளை கண்டறிதலோடு அதே முறைகளைப் பயன்படுத்தி அவை ஈடுபடும் வேதிவினைகளின் வலுவறிதலையும் உள்ளடக்கியதாகும். கரிம வேதிப்பொருட்களின் வேதிவினைகள் பற்றிய கல்வியானது கோட்பாடுகளின் வழிநின்றும் ஆய்வகங்களில் செயற்கை முறைகளிலும் கரிம வேதிப்பொருட்களை தயாரிக்கும் முறைகள் பற்றியதாகும்.
கரிம வேதியியல் ஆய்வின் பரப்பு ஐதரோகார்பன்கள் தொடங்கி கார்பனை அடிப்படையாகக் கொண்டு அவற்றின் அமைப்பில் பங்கேற்கும் பிற தனிமங்களைப் பற்றிய ஆய்வாகவும் நீள்கிறது. மேலும் கரிம வேதியியலானது மருந்தாக்க வேதியியல், உயிர் வேதியியல், கரிம உலோக வேதியியல், பல்படிமமீச்சேர்ம வேதியியல் மற்றும் பரந்துபட்ட பொருளறிவியலின் பல்வேறு பண்புக்கூறுகள் வரை விரிந்திருக்கிறது.
கரிம கலவைகள் அனைத்தும் புவி வாழ்க்கையின் அடிப்படையில் உருவாகின்றன. அவை கட்டமைப்புரீதியில் பல்வேறு வகைப்பட்டனவாக மாறுபட்டு கிடக்கின்றன. கரிம கலவைகளின் பயன்பாடு மகத்தான வரம்புகளை கொண்டுள்ளது. அவை நெகிழி, மருந்து, கச்சா எண்ணெய், உணவு, வெடிபொருள், மற்றும் வண்ணப்பூச்சுகள் உட்பட பல முக்கியமான பொருட்களின் பகுதிப்பொருட்களாகவும் உள்ளன.
வரலாறு[தொகு]
பொதுவாக உயிர்விசைக் கொள்கையின் அடிப்படையில் உயிரினங்களில் இருந்து கொடையாகப் பெறப்பட்ட சேர்மங்கள் கனிம சேர்மங்களிலிருந்து வேறுபட்டு நிற்கின்றன என்று பத்தொன்பதாம் நூற்றாண்டிற்கு முன்பு வேதியியல் அறிஞர்களால் நம்பப்பட்டது. அதாவது உயிர்விசைக் கருத்துப்படி கரிமப் பொருள்கள் யாவும் உயிர்விசையின் கொடைகளாகும். பெர்சிலியஸ் என்ற விஞ்ஞானி கரிம சேர்மங்களைப் பற்றி விளக்க உயிர் செயல்முறை சார்ந்த இன்றியமையா உயிர்விசைக் கொள்கையை வெளியிட்டார்.
பத்தொன்பதாம் நூற்றாண்டின் முதல் பாதியில், கரிம சேர்மங்கள் தொடர்பான திட்டமிட்ட ஆய்வுகள் பற்றிய சில தகவல்கள் முதல் முறையாக வெளிவந்தன. சுமார் 1816 ஆம் ஆண்டில் மைக்கேல் செவ்ரியுல் என்ற விஞ்ஞானி பல்வேறு கொழுப்புகள் மற்றும் காரங்களால் செய்யப்பட்ட சோப்புகள் பற்றிய ஒரு ஆய்வைத் தொடங்கினார். காரங்கள் பல்வேறு வகையான அமிலங்களுடன் சேர்ந்து பல்வேறு வகையான சோப்புகளை உற்பத்தி செய்கின்றன என்று கூறிய அவர், உயிர்விசையின்றி கொழுப்புகளில் வேதிமாற்றத்தை ஏற்படுத்தி புதிய சேர்மங்களை உருவாக்க முடியும் என்று விளக்கமளித்தார்.
கரிமவேதியியல் என்ற சொல், தாவரங்கள் மற்றும் விலங்கினங்களிடமிருந்து பெறப்பட்ட சேர்மங்களையே குறிப்பதாக இருந்தது. தாவரங்களிலிருந்து பெறப்பட்ட சேர்மங்கள் கார்பன், ஐதரசன், ஆக்சிசன் – ஐயும் விலங்கினங்களிடமிருந்து பெறப்பட்ட சேர்மங்கள் கார்பன், ஐதரசன், ஆக்சிசன், நைட்ரசன், கந்தகம், பாசுபரசு போன்ற தனிமங்களையும் கொண்டுள்ளன என்பதை வேதியியலின் தந்தை என்றழைக்கப்பட்ட லவாய்சியர் என்ற விஞ்ஞானி நிருபித்துக் காட்டினார்.
கி.பி 1828 ஆம் ஆண்டு ஹோலர் என்றழைக்கப்பட்ட விஞ்ஞானி, அம்மோனியம் சயனேட்டு எனும் கரிம சேர்மத்திலிருந்து முதன்முதலில் யூரியா எனும் கரிம சேர்மத்தை சோதனைச் சாலையிலேயே தயாரித்துக் காட்டினார். இக்கண்டுபிடிப்பு இன்றியமையா விசைக்கொள்கையை அர்த்தமற்றதாக்கி விட்டது.
2KCNO + (NH4)2SO4 → 2NH4CNO + K2SO4 (அல்லது)
Pb(NCO)2 + 2NH4OH → Pb(OH)2 + 2NH4(NCO)
NH4(NCO) → NH2CONH2
1845 ஆம் ஆண்டு கோல்ப் என்றழைக்கப்பட்ட விஞ்ஞானி, சோதனைச்சாலையில் தனிமங்களிலிருந்தே அசிட்டிக் அமிலத்தை முதன் முதலாக தயாரித்தார். இக்கண்டுபிடிப்பு இன்றியமையா விசைக்கொள்கையை மேலும் அர்த்தமற்றதாக்கி விட்டது.
கி.பி 1856 ஆம் ஆண்டில் வில்லியம் என்றி பெர்கின் என்பவர் குயினைன் உற்பத்தி செய்ய முயற்சிக்கும் போது, தற்செயலாக இப்போது பெர்கினின் மெல்லிய ஊதாநிறச்சாயம் என்று அழைக்கப்படும் கரிம சாயம் உற்பத்தியானது. இச்சாயம் தந்த பொருளாதார வெற்றியினால் கரிம வேதியியல் துறை கண்டுபிடிப்புகளில் ஆர்வம் அதிகரித்தது.
கி.பி.1858 ல் பிரெடெரிக் ஆகஸ்ட் கெக்கூலே மற்றும் ஆர்ச்சிபால்ட் ஸ்காட் கூப்பர் இருவரும் தனித்தனியாக ஆனால் ஒரே நேரத்தில் உருவாக்கிய இரசாயன அமைப்பு கருத்துதான் கரிம வேதியியலின் முக்கிய திருப்புமுனையாக அமைந்தது.
கரிம அணுவின் இணைதிறன் நான்காக இருப்பதால் ஒரு கரிம அணு மற்ற கரிம அணுக்களுடன் பிணைப்பை ஏற்படுத்தி சங்கிலித்தொடர் கரிம அணுக்கோவையாக உருவாகிறது. மற்றும் பொருத்தமான இரசாயண வேதிவினைகளை நுணுகி விளக்க முற்படுவதன் மூலமாக அணுப்பிணைப்பு பற்றிய விரிவான வடிவங்களையும் உய்த்துணர முடியும் என்று இருவருமே பரிந்துரைத்தனர்.
ஜெர்மனியில், அசெடைல் சாலிசிலிக் அமிலம் (தற்பொழுது ஆஸ்பிரின் என்றழைக்கப்படுகிறது). உற்பத்தி பேயர் என்பவரால் தொடங்கப்பட்டு 19 ஆம் நூற்றாண்டின் கடைசி பத்தாண்டுகளில் மருந்து தொழில் தொடங்கியது. முதன் முதலாக கொடிய மேகநோய்க்கான ஆர்ச்பினாமின் என்ற மருந்து (வணிக பெயர் – சல்வார்சன்) திட்டமிடப்பட்டு தயாரிக்கப்பட்டது.
இதற்காக பால் எர்லிச் அவருடைய குழுவினருடன் இணைந்து அபாயகரமான நச்சுத்தன்மை கொண்ட ஆர்சனிக் அமிலத்தின் (ஆடாக்சில்) எண்ணற்ற கிளைப்பொருட்களை ஆய்வு செய்தபோதிலும் சிறந்த செயல்திறன் மற்றும் நச்சுத்தன்மை பண்புகளைக் கொண்ட சேர்மத்தையே உற்பத்திக்காக தேர்ந்தெடுத்துக் கொண்டார்.
கரிம வினைகள் மற்றும் பயன்பாடுகள் குறித்த ஆரம்பகால உதாரணங்கள் பெரும்பாலும் தற்செயல்களாகவே இருந்தன. கரிம சேர்மங்கள் தொடர்பான முறையான ஆய்வுகள் 19 ஆம் நூற்றாண்டின் பிற்பாதியில் தொடங்கப்பட்டு இண்டிகோ (C16H10N2O2) என்ற நீலநிறச் சாயம் செயற்கை முறையில் தயாரிக்கப்பட்டு பின்னர் வளர்ச்சி கண்டது. 1897ல் தாவர மூலங்களிடமிருந்து பெறப்பட்ட இண்டிகோவின் அளவு 19000 டன்களிலிருந்து 1914-ல் 1000 டன்களாக குறைந்தது. இவ்வளர்ச்சி செயற்கை முறையில் இண்டிகோ தயாரித்த அடோல்ப் வோன் பேயரையே சார்ந்ததாகும். 2002 ஆம் ஆண்டில் சுமார் 17000 டன்கள் செயற்கை இண்டிகோ பெட்ரோ வேதிப் பொருட்களிலிருந்து தயாரிக்கப்பட்டுள்ளது.
20 ஆம் நூற்றாண்டின் முற்பகுதியில் மீச்சேர்மங்களும் உயிர் வினையூக்கிகளும் மிகப்பெரிய கரிம மூலக்கூறுகளாக அறியப்பட்டன. பெட்ரோலியம் உயிரினங்களிடமிருந்து பெறப்பட்ட கரிம சேர்மமாக கருதப்பட்டது.
சிக்கலான கரிம சேர்மங்களை பலகட்ட இணைப்புகள் தொகுக்கும் செயற்கை முறையில் சேர்மங்கள் தயாரிக்கப்படுகின்ற முறை மொத்த கூட்டிணைப்பு வினை என அழைக்கப்படுகிறது. சிக்கலான கரிம சேர்மங்களான குளுக்கோசு மற்றும் டெர்பினால் போன்ற சேர்மங்களைத் தொகுக்கும் மொத்த கூட்டிணைப்பு வினை கூடுதல் சிக்கலான கரிமச்சேர்மங்களை அடையாளம் காட்டியது. எடுத்துக்காட்டாக, கொழுப்பு சார்ந்த சேர்மங்களை மொத்த கூட்டிணைப்பு வினைக்கு உட்படுத்தும்போது மேலும் சிக்கல் நிறைந்த மனித ஹார்மோன்கள் மற்றும் அவற்றின் கிளைப்பொருட்களை தயாரிக்கும் செயற்கை உற்பத்தி முறைக்கான வழிகளைத் திறந்துவிட்டது. 20 – ஆம் நூற்றாண்டின் தொடக்கத்தில் இருந்து மொத்த கூட்டிணைப்பு வினையின் தாக்கம் சிக்கலான லைசெரிக் அமிலம் மற்றும் வைட்டமின் பி 12 போன்ற உயர் சிக்கல் மூலக்கூறுகள் வரை அதிகரிக்கப்பட்டுள்ளது.
மொத்த கூட்டிணைப்பு வினை மூலமாக வைட்டமின் பி12 ஐ தயாரித்தது கரிம வேதியியலின் மிகச் சிறந்த சாதனையாகும்.
பெட்ரோலியம் மற்றும் பெட்ரோலிய வேதியியல் தொழில் வளர்ச்சியின் கண்டுபிடிப்பால் கரிம வேதியியல் துறை பெரிதும் வளர்ச்சி கண்டது. பெட்ரோலியத்திலிருந்து பெறப்பட்ட கரிம சேர்மங்களை பல்வேறு ரசாயன முறைகள் மூலம் பிற வகையான கரிம சேர்மங்களாக மாற்றும்போதுதான் பெட்ரோலிய வேதியியல் தொழில் பிறந்தது. இத்தொழிற்சாலைகள் மூலமாக செயற்கை ரப்பர்கள், பல்வேறு கரிம பசைகள், பெட்ரோலியக் கூட்டுப் பொருள்கள், நெகிழிகள் முதலியன வெற்றிகரமாக தயாரிக்கப்பட்டன.
உயிரினங்களிடமிருந்து கிடைக்கும் பெரும்பான்மையான வேதிப்பொருட்கள் உண்மையில் கரிமத்தின் கூட்டுப் பொருள்களேயாகும். ஆகவே கரிமவேதியியல் மற்றும் உயிர் வேதியியல் ஆகிய இரண்டு துறைகளும் ஒன்றுக்கொன்று மிகவும் நெருக்கமானவையாக உள்ளன. உயிர்வேதியியலின் சாரம்சம் கரிம வேதியியலின் ஒரு பிரிவாக கருதப்படுகிறது.
சில நான்கு நூற்றாண்டுகள் உயிர் வேதியியியலின் வரலாறு வெளிச்சத்திற்கு வராமல் இருந்தபோதிலும் உயிர் வேதியியல் துறையின் அடிப்படை புரிதல்கள் மட்டுமே 19 ஆம் நூற்றாண்டின் பிற்பகுதியில் உருவாகத் தொடங்கியது. உயிர்வேதியியலின் உண்மையான கால வரலாறு 20 ஆம் நூற்றாண்டின் தொடக்க காலத்தில் உருவாக்கப்பட்டது. பின்னர் இருபதாம் நூற்றாண்டு முழுவதும் உயிர் வேதியியல் ஆய்வுகள் நிகழ்ந்தவண்ணம் இருந்தன. எந்தவிதமான் அறிகுறியும் இல்லாமல் தளர்வின்றி நிகழ்ந்த இந்த ஆய்வுகள் வேறுபடுத்துதல் மற்றும் அட்டவணைப்படுத்துதல் சேவை செய்துகொண்டிருந்த அமைப்புகளால் சரி பார்க்கப்பட்டன. வாழ்க்கை அறிவியல் சார்ந்த தகவல் களஞ்சியம் (BIOSIS Previews) என்ற அமைப்பும் வாழ்க்கை அறிவியல் சார்ந்த ஆதார நூற் பட்டியல் (Biological abstracts) என்ற அமைப்பும் 1920 ஆம் ஆண்டில் துவக்கப்பட்டவையாகும். இருபதாம் நூற்றாண்டின் இறுதியில் தினசரி பயனர்கள் பயன்படுத்துமளவிற்கு நேரிடை மின்னணு தகவல் களஞ்சியமாக உயிர் வேதியியல் துறை அசுர வளர்ச்சி கண்டுள்ளது.
பண்பாய்வியல்[தொகு]
கரிம சேர்மங்கள் பெரும்பாலும் கலவைகளாகவே காணப்படுவதால் அவற்றின் தூய்மையை மதிப்பிட பல்வேறு வகையான பிரிகை நுட்பங்களும் உருவாக்கப்பட்டன. குறிப்பாக நிறவியல், உயர் செயல்திறன் திரவ நிறவியல் மற்றும் வாயு நிறவியல் ஆகியன முக்கியத்துவம் பெற்றிருந்தன. வடித்தல், படிகமாக்கல், வீழ்படிவாக்குதல், கரைப்பானில் இருந்து பிரித்தெடுத்தல் ஆகிய முறைகள் கரிமசேர்மங்களின் தூய்மையை மதிப்பிட உதவும் பாரம்பரிய முறைகளாக இருந்தன.
கரிம சேர்மங்கள் பாரம்பரிய முறைகளின்படி பல்வேறு வகையான இரசாயண சோதனைகள் மூலம் பண்பாய்வு செய்யப்பட்டு வந்தாலும் அம்முறைகள் நாளடைவில் நிறமாலையியல் மற்றும் செறிவான கணிப்பொறி வழி ஆய்வு போன்ற முறைகளால் பின்னுக்குத் தள்ளப்பட்டன. தோராயமான பயன்பாட்டு ஒழுங்கின்படி வரிசைப்படுத்தப்பட்டுள்ள முதன்மையான ஆய்வு முறைகள் சில கீழே தரப்பட்டுள்ளன.
அணுக்கரு காந்த ஒத்திசைவு (என்எம்ஆர்) நிறமாலையியல்[தொகு]
பொதுவாக அதிக அளவில் பயன்படுத்தப்படும் தொழில் நுட்பமுறை இதுவாகும். அடிக்கடி உடன்தொடர்பு நிறமாலையியலைப் பயன்படுத்தி அணு இணைப்பு மற்றும் முப்பரிமாண வேதியியலை முழுமையாக வகுத்தளிப்பது இம்முறையின் நுட்பமாகும். இயல்பாகவே கரிம வேதியியல் உள்ளடக்கிய முக்கிய அணுக்களான ஐட்ரசன் மற்றும் கார்பன் அணுக்கள் அணுக்கரு காந்த ஒத்திசைவில் இயல்பாகவே 1H மற்றும் 13C ஐசோடோப்புகளுக்கு பதிலளிக்கின்றன.
மூல பகுப்பாய்வுகள்[தொகு]
ஒரு மூலக்கூறின் அடிப்படை அமைப்பை தீர்மானிக்க பயன்படுத்தப்படுத்தப்படும் ஒரு அழித்தல் முறையாகும். உதாரணமாக தாதுப்பொருட்கள், இராசாயனக் கலவைகள் போன்றவற்றை அடிப்படை பகுப்பாய்வு செய்து அவற்றின் மூலங்கள் மற்றும் ஐசோடோப்புகளை கண்டறிய முயல்வது இம்முறையாகும்.
நிறை நிறமாலையியல்[தொகு]
நிறை நிறமாலையியலானது ஒரு சேர்மத்தின் மூலக்கூறு எடையை அதன் மூலக்கூறு அமைப்பு அது துண்டாகும் வடிவங்கள் இவற்றின் அடிப்படையில் கூறுகிறது. உயர் தீர்மான நிறமாலையியல் பொதுவாக ஒரு சேர்மத்தின் சரியான சூத்திரத்தை அடையாளம் காட்டுகிறது. இம்முறை அடிப்படை பகுப்பாய்வு முறைக்குப் பதிலாக பயன்படுத்தப்படுகிறது. முற்காலங்களில் நிறை நிறமாலையியலானது பெரும்பாலும் நடுநிலையான மூலக்கூறுகளில் மட்டுமே பயன்படுத்தப்பட்டது. ஆனால் மேம்பட்ட அயனி நுட்பங்கள் எந்த கரிம கலவையாக இருந்தாலும் பகுப்பாய்வு பெற அனுமதிக்கின்றன.
படிகவியல் மூலக்கூறு வடிவியல்[தொகு]
படிகவியல் மூலக்கூறு வடிவியல் என்பது மூலக்கூறு வடிவியலை வேறுபாடு ஏதுமின்றி உறுதிபடுத்தும் ஒரு தெளிவான முறையாகும். பொருளின் ஒற்றை படிகமாவது கண்டிப்பாக இருக்க வேண்டும் என்பதும், அந்த படிகம் உறுதிப்படுத்த வேண்டிய பொருளுக்கு உருமாதியாகவும் இருக்கவேண்டும் என்பதே இதற்குத் தேவையான ஒரே நிபந்தனையாகும். மிகை தானியங்கி மென்பொருள் பொருத்தமான படிகத்தின் வடிவத்தை ஒருமணி நேரத்திற்குள் தீர்மானிக்கிறது.
அகச்சிவப்பு நிறமாலை, ஒளியியல் சுழற்சி, புறஊதாக் கதிர் காட்சி நிறமாலை போன்ற பாரம்பரிய நிறமாலையியல் முறைகள் ஒப்பீட்டளவில் குறிப்பிடப்படாத கட்டமைப்பு தகவல்களை வழங்குகின்றன. ஆனால் அவை குறிப்பிட்ட வகுப்பு சேர்மங்களுக்கான முறையாக பயன்பாட்டில் உள்ளது.
பண்புகள்[தொகு]
பொதுவாக கரிம சேர்மங்களின் இயற்பியற் பண்புகள் அவற்றின் அளவு மற்றும் பண்பியல் அம்சங்கள் இரண்டையும் உள்ளடக்கியிருக்கும். உருகுநிலை, கொதிநிலை, மற்றும் ஒளிவிலகல் எண் ஆகிய கூறுகள் அளவு சார்ந்த பண்புகளிலும் நிறம், மணம், கரைதிறன் மற்றும் நிலைப்புத்தன்மை ஆகிய கூறுகள் பண்பியல் சார்ந்த பண்புகளிலும் அடங்கும்.
உருகுநிலை மற்றும் கொதிநிலை பண்புகள்[தொகு]
பெரும்பாலான கனிம சேர்மங்களுக்கு மாறாக கரிம சேர்மங்கள் பல உருகுகின்றவையாகவும் பல கொதிக்கின்றவையாகவும் உள்ளன. முந்தைய காலங்களில், உருகுநிலை (MP) மற்றும் கொதிநிலை (BP) ஆகிய பண்புகள் கரிம சேர்மங்களின் தூய்மை மற்றும் அடையாளம் குறித்த முக்கியமான தகவல்களை வழங்கின. உருகுநிலையும் கொதிநிலையும் மூலக்கூறு எடை மற்றும் காந்தச்சக்தியுடன் ஒன்றுக்கொன்று தொடர்புடையனவாக இருந்தன. ஒத்த பரிமாணமுள்ள சில் கரிம சேர்மங்கள் பதங்கமாகின்றன. அதாவது அவை உருகாமல் நேரடியாக வாயு நிலைக்குச் சென்று விடுகின்ற்ன. துர்நாற்றம் வீசக்கூடிய பாரா டைகுளோரோ பென்சீன் பதங்கமாதலுக்கு சரியான ஓர் உதாரணமாகும். பொதுவாக சில கரிம சேர்மங்கள் தவிர மற்றவை 300 பாகை செல்சியசுக்கு மேல் அதிக நிலைப்புத் தன்மை கொண்டவையாக இருப்பதில்லை.
கரைதிறன்[தொகு]
நடுநிலைமையான கரிம சேர்மங்கள் கரிம கரைப்பான்களை விட தண்ணீரில் குறைவாகக் கரையக்கூடியனவாக உள்ளன. அயனியாகும் தொகுதிகளைக் கொண்ட கரிம சேர்மங்கள மற்றும் குறைந்த மூலக்கூறு எடை கொண்ட ஆல்ககால்கள், அமைன்கள், நீரகப் பிணைப்பை ஏற்படுத்தக்கூடிய கார்பாக்சிலிக் அமிலங்கள் போன்றவை விதிவிலக்குகளாகும். கரிம சேர்மங்கள் கரிம கரைப்பான்களில் நன்றாக கரைகின்றன. தூய்மையான ஈதர் அல்லது ஈத்தைல் ஆல்ககால் அல்லது பெட்ரோலியம் ஈதர் மற்றும் வெள்ளைச்சாராயம் போன்ற மெழுகு வகை கலவை கரைப்பான்கள் அல்லது தூய அல்லது கலப்பட நறுமண கரைப்பான்கள் போன்றவை அக்கரைப்பான்களுக்கு உதாரணங்களாகும். கரிம சேர்மங்களின் கரைதிறன் அவை கரையக்கூடிய கரைப்பான்களின் தன்மையைப் பொருத்தும் அசிசேர்மத்துடன் இணைந்துள்ள செயல்படும் தொகுதிகளைப் பொருத்தும் அமைகிறது.
திடநிலைப் பண்புகள்[தொகு]
படிக மூலக்கூறுகள் மற்றும் கரிம பாலிமர்கள் போன்ற இணைக்கப்பட்ட அணுக்கூட்டுகளின் பயன்பாட்டில் பல்வேறு சிறப்புப் பண்புகள் கரிம சேர்மங்களிடம் காணப்படுகின்றன. உதாரணமாக நீர்ம இயந்திரவியல் மற்றும் மின்னணு இயந்திரவியலில் அமுக்க மின்சாரம், மின் கடத்தல் மற்றும் மின்னணு ஒளியியல் போன்ற பண்புகள் சிறப்புப் பண்புகளாக உள்ளன. வரலாற்று காரணங்களுக்காக பிரதானமாக பாலிமர் விஞ்ஞானம் மற்றும் பொருளியல் விஞ்ஞானம் போன்ற பகுதிகளில் இப்பண்புகள் காணப்பட்டன.
பெயரிடுதல்[தொகு]
இக்காலங்களில், கரிம வேதியியல் என்பது கார்பன் சேர்மங்களின் வேதியியல் என்றும் ஐதரோகார்பன்களும் அவற்றின் வழி பெறுதிகளுடைய வேதியியல் என்றும் வரையறுக்கப்படுகிறது. கரிம சேர்மங்கள், கனிம சேர்மங்களைப் போன்றே, வேதியியலின் அடிப்படை விதிகளுக்கு ஒத்துப் போகின்றன. எனினும் கரிம வேதியியல் ஒரு தனி வேதியியல் பகுதியாகக் கருதப்படுவதற்குக் காரணம்:
- எல்லா கனிம வேதிகளின் எண்ணிக்கையை விட கரிம வேதிகளின் எண்ணிக்கை மிக அதிகம்;
- இயைபு, அமைப்பு மற்றும் பண்புகளில் கரிம சேர்மங்கள் கனிம சேர்மங்களிடமிருந்து வெகுவாக மாறுபடுகின்றன; மாற்றியம், சுய சகபிணைப்பை உண்டாக்கும் தன்மை ஆகியவை கரிம சேர்மங்களுக்கே உரித்தான பண்புகளாகும்.
கார்பனின் (கரிமம்) வலுவளவு நான்கு ஆகும். எனவே கார்பன் ஏனைய மூலகங்களிலும் (தனிமங்கள்) பார்க்க அதிக பிணைப்புக்களை உருவாக்க முடியும். மேலும் கார்பன் ஏனைய மூலகங்களுடன் சேர்ந்து உருவாக்கும் பிணைப்புக்களின் பிணைப்புச் சக்தியும் குறைவாகும்[2]. இதன் காரணமாக கார்பன் இயற்கையில் அதிக சேர்வைகளை உருவாக்குகிறது.
கரிம சேர்மங்கள் சில விதிகளின் அடிப்படையிலோ அல்லது பாரம்பரியமாக அழைக்கப்படும் பல்வேறு மரபுகளை பின்பற்றி புழக்கத்தில் உள்ள பெயர்களால் பெயரிடப்படுகின்றன. அடிப்படை மற்றும் பயன்சார்ந்த வேதியியலின் பன்னாட்டு சங்கம் (IUPAC) கரிம சேர்மங்களை பெயரிடுவதற்கு சில விதிமுறைகளை வகுத்துள்ளது. முறையான அபவேபச – தின் (அடிப்படை மற்றும் ப்யன்சார்ந்த வேதியியலின் பன்னாட்டு சங்கம் பெயரிடுதல் தெளிவாகக் காணப்படும் மூலக்கூறுகளின் அமைப்பியல் தோற்றத்திலிருந்து தொடங்குகிறது. இந்த அடிப்படை சொல் பின்னர் பின்னொட்டு, முன்னொட்டு மற்றும் எண்களால் திருத்தம் செய்யப்பட்டு ஐயத்திற்கிடமின்றி சேர்மத்தின் மூலக்கூறு அமைப்பை விளக்குகிறது. அபவேபச – தின் கடுமையான விதிமுறைகளின் அடிப்படையில் பல இலட்சக்கணக்கான எளிய கரிம சேர்மங்களின் பெயர்கள் அறியப்படுகின்றன. சிக்கலான கரிம சேர்மங்களின் அபவேபச – தின் பெயரிடுதல் சிக்கலாகவே உள்ளது. முறையான பெயரிடும் முறையை உப்யோகித்து ஒரு சேர்மத்திற்கு பெயரிட ஒருவர் அச்சேர்மத்தின் மரபுசார் கட்டமைப்பின் பெயர், மூலக்கூறு அமைப்பு ஆகியனவற்றை அறிந்து கொள்ளவேண்டும். மரபுசார் கட்டமைப்பு என்பது பதிலிடப்படாத ஐதரோ கார்பன்கள், பல்லின வளைய சேர்மங்கள், ஒற்றை செயல்படு தொகுதிகள் அமைந்த சேர்மங்கள் ஆகியன்வற்றை உள்ளடக்கியதாகும். மரபுசார்ந்த புழக்கத்தில் உள்ள பெயர்கள் எளிமையானதாகவும் திரிபுகளின்றியும் குறைந்த பட்சமாக வேதியியலார்க்கு மட்டும் பயன்படுவதாக இருந்தது. இப்பெயர்கள் சேர்மங்களின் மூலக்கூறு அமைப்பை சுட்டிக்காட்டவில்லை. மேலும் இப்பெயர்கள் சிக்கலான கூட்டமைப்பு சேர்மங்களுக்கு பொதுப் பெயர்களையே வழங்கின. நாளடைவில் கணிப்பொறிகளின் தாக்கத்தால் புதிய பெயரிடும் முறைகள் பழக்கத்திற்கு வந்தன.
மூலக்கூறு வடிவங்களை வரைதல்[தொகு]
கரிம மூலக்கூறுகள் பொதுவாக வரைபடங்கள் அல்லது வேதியியல் குறியீடுகளின் இணைப்பிலான கட்டமைப்பு வாய்ப்பாடுகள் மூலம் விவரிக்கப்படுகின்றன. குறிப்பாக வரி கோண வாய்ப்பாடுகள் எளிமையாகவும் அய்யமின்றி தெளிவாகவும் காணப்படுகின்றன. இம்முறையில் ஒவ்வொரு வரிசையின் இறுதி மற்றும் வரிசை சந்திப்புகளில் ஒரு கார்பன் மற்றும் ஒரு நீரகம் அணுக்கள் வெளிப்படையாக அல்லது கார்பனின் நான்கு இணைதிறனை நிறைவு செய்யும் விதத்தில் மறைமுகமாக காணப்படுகின்றன. மூலக்கூறு வரைபடங்கள் கொண்டு கரிம சேர்மங்களை விவரிப்பது மிகவும் எளிமையாகும். கிட்டத்தட்ட அனைத்து கரிம சேர்மங்களிலும் கார்பன் நான்கு பிணைப்புகள், நைட்ரஜன் மூன்று பிணைப்புகள், ஆக்சிஜன், இரண்டு பிணைப்புகள் மற்றும் ஹைட்ரஜன் ஒரு பிணைப்பையும் பெற்றுள்ளது என்ற உண்மையை எளிதாக உணரலாம்.
செயல்படு தொகுதிகள்[தொகு]
கரிம வேதியியலில் மூலக்கூறு கட்டமைப்புகளை வடிவமைப்பதும் சேர்மத்தின் பண்புகளை முன்கூட்டியே கணிக்கவும் உதவுவது அச்சேர்மத்துடன் இணைந்துள்ள செயல்படு தொகுதிகளேயாகும். ஒரு செயல்படு தொகுதி என்பது ஒரு சிறிய கட்டமைப்பு அலகு ஆகும். இந்த சிறிய அலகின் வேதிவினை பல்வேறு வகயான சேர்மங்களிலும் மாறாமல் இருக்கும் என சில வரையறைக்குட்பட்டு முன்கூட்டியே அனுமானிக்கலாம். இச்செயல்படு தொகுதிகள் கரிம சேர்மங்களின் இயற்பியல் மற்றும் வேதியியல் பண்புகளை நிர்ணயிப்பதில் பெரும்பங்கு வகிக்கின்றன. மூலக்கூறுகள் செயல்படு தொகுதிகளின் அடிப்படையிலேயே வகைப் படுத்தப்படுகின்றன. உதாரணமாக எல்லா ஆல்ககால்களும் C – O – H என்ற கிளை அலகைப் பெற்றுள்ளன. இச்செயல்படு தொகுதியின் மூலம் எல்லா ஆல்ககால்களும் கிட்டத்தட்ட நீர்மைத்தன்மை கொண்டிருக்கும். எல்லா ஆல்ககால்களும் எஸ்டர்களை உருவாக்கும். எல்லா ஆல்ககால்களிலிருந்தும் அதேவரிசை ஆலைடுகளை உருவாக்கலாம். பெரும்பாலான செயல்படு தொகுதிகள் கார்பன், ஐதரசன் தவிர்த்த பல அணுக்களால் ஆகியுள்ளன. கரிம வேதியியலில் கரிம சேர்மங்கள், செயல்படு தொகுதிகளின் அடிப்படையிலேயே வகைபடுத்தப்படுகின்றன. கீழே செயல்படு தொகுதிகளின் வாய்பாடுகளும் பெயர்களும் கொடுக்கப்பட்டுள்ளன.
1. ஆல்கைல் ஆலைடு – X
2. ஆல்ககால் – OH
3. ஈதர் – O –
4. ஆல்டிகைடு – CHO
5. நைட்ரோ சேர்மம் – NO2
6. கீட்டோன் – C = O
7. கார்பாக்சிலிக் அமிலம் – COOH
8. எச்டர் – COOR
9. அமைடு O = C-NH2
10. அமில ஆலைடு O = C – X { X = Cl, Br, I }
11. அமில நீரிலி O = C – O – C = O
12. அமீன் – NH2
கரிம சேர்மங்கள் அல்லது சேதனச் சேர்வைகளின் வகைகள்[தொகு]
கரிம சேர்மங்கள் அல்லது சேதனச் சேர்வைகள் பிரதானமாக இரண்டு வகைப்படும். அவையாவன:
- அலிபாட்டிக் சேர்மங்கள் அல்லது திறந்த சங்கிலித் தொடர் சேர்மங்கள் அல்லது வளையமில்லா சேர்மங்கள்.
- அரோமேட்டிக் சேர்மங்கள் அல்லது மூடிய சங்கிலித்தொடர் சேர்மங்கள் அல்லது வளைய சேர்மங்கள்.
அலிபாட்டிக் [3] சேதனச் சேர்வைகள்[தொகு]
இவ்வகை சேர்மங்களில் கார்பன் அணுக்கள் நேர்கோட்டு அமைப்பிலோ அல்லது கிளை சங்கிலித்தொடர் அமைப்பிலோ நீண்ட சங்கிலியைக் கொண்டிருக்கும்.இவை மூடிய அமைப்பில்லாத திறந்த அமைப்பைக் கொண்டுள்ள கரிம சேர்மங்களாகும். கிரேக்க மொழியில் அலிபாட் என்றால் கொழுப்பு என்பது பொருளாகும். அலிபாட்டிக் சேர்மங்கள் மேலும் நிறைவுற்றவை (ஆல்கேன்கள்)என்றும், நிறைவுறாதவை (ஆல்கீன்கள்,ஆல்கைன்கள்) எனவும் அலிசைக்ளிக் (வளைய ஆல்கேனகள்), எனவும் பகுக்கப்பட்டுள்ளன.
அல்கேன்கள்[தொகு]
கார்பன் அணுக்களுக்கிடையில் ஒற்றைப் பிணைப்பை மாத்திரம் கொண்ட சேர்வைகள் அல்கேன்களாகும்.
அல்கீன்கள்[தொகு]
காபன் அணுக்களிடையே இரட்டைப்பிணைப்புகளைக் கொண்டுள்ள சேர்வைகள் அல்கீன்களாகும்.
அல்கைன்கள்[தொகு]
காபன் அணுக்களிடையே மும்மைப்பிணைப்புகளைக் கொண்டுள்ள சேர்வைகள் அல்கைன்களாகும்.
அரோமேட்டிக் [4] சேதனச் சேர்வைகள்[தொகு]
பென்சீன் வளையத்தைக் கொண்ட சேதனச் சேர்வைகளாகும்
தொழிற்பாட்டுக் கூட்டத்தைக் கொண்டு வகைப்படுத்தல்[தொகு]
தொழிற்பாட்டுக் கூட்டம்[தொகு]
சேதனச் சேர்வையொன்றின் விஷேட இயல்புகள் மற்றும் தாக்கங்களுக்குப் பொறுப்பான அணுக்கள் அல்லது அணுக்கூட்டங்கள் தொழிற்பாட்டுக் கூட்டங்கள் எனப்படும்.
சில பிரதான சேர்வைகள்[தொகு]
பின்வரும் அட்டவணை சில பிரதான சேதனச் சேர்வைகளின் விபரங்களைத் தருகிறது.
| பெயர் | கூட்டம் | சூத்திரம் | கட்டமைப்புச் சூத்திரம் | முன்னொட்டு | பின்னொட்டு | உதாரணம் |
|---|---|---|---|---|---|---|
| அல்கேன் | அல்கைல் | RH | alkyl- | -ane |  எதேன் | |
| அல்கீன் | அல்கீனைல் | R2C=CR2 | 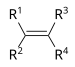
|
alkenyl- | -ene | 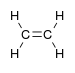 எதிலீன் (Ethene) |
| அல்கைன் | அல்கைனல் | RC≡CR' | alkynyl- | -yne | அசெற்றலீன் (Ethyne) | |
| பென்சீன் | பீனைல் | RC6H5 RPh |
phenyl- | -benzene | 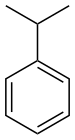 Cumene (2-phenylpropane) | |
| தொலுயீன் | பென்சைல் | RCH2C6H5 RBn |
benzyl- | 1-(substituent)toluene | Benzyl bromide (α-Bromotoluene) | |
| ஹாலோஅல்கேன் | ஹலோ | RX | halo- | alkyl halide | Chloroethane (Ethyl chloride) | |
| ஃபுளோரோஅல்கேன் | ஃபுளோரோ | RF | fluoro- | alkyl fluoride | 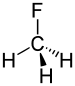 Fluoromethane (Methyl fluoride) | |
| குளோரோஅல்கேன் | குளோரோ | RCl | chloro- | alkyl chloride | 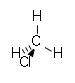 குளோரோமீத்தேன் (Methyl chloride) | |
| புரோமோஅல்கேன் | புரோமோ | RBr | bromo- | alkyl bromide | 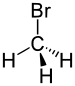 Bromomethane (Methyl bromide) | |
| அயடோஅல்கேன் | அயடோ | RI | iodo- | alkyl iodide |  Iodomethane (Methyl iodide) | |
| அல்ககோல் | ஹைட்ரொக்ஸில் | ROH | 
|
hydroxy- | -ol | 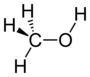 மெதனோல் |
| கீட்டோன் | காபனைல் | RCOR' | 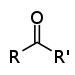
|
-oyl- (-COR') or oxo- (=O) |
-one | 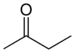 Butanone (Methyl ethyl ketone) |
| அல்டிகைட் | அல்டிகைட் | RCHO | 
|
formyl- (-COH) or oxo- (=O) |
-al |  Ethanal (அசிட்டால்டிகைடு) |
| அசற்றைல் ஹேலைட் | ஹலோஃபோர்மைல் | RCOX | 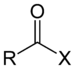
|
carbonofluoridoyl- carbonochloridoyl- carbonobromidoyl- carbonoiodidoyl- |
-oyl halide |  Acetyl chloride (Ethanoyl chloride) |
அறிவியல் சொற்கள்[தொகு]
அடிக்குறிப்புகள்[தொகு]
- ↑ பாவனை என்ற சொல் பயன்பாடு என்ற பொருளில் இலங்கைத் தமிழர் மத்தியில் புழக்கத்தில் உள்ளது. பொதுவாகப் பாவனை என்பது ஒன்றைப் பார்த்து அதுபோலச் செய்தல் என்ற பொருளைக் கொடுக்கும் (எ-கா: கானமயிலாடக் கண்டிருந்த வான்கோழி தானும் அதுவாகப் பாவித்து...). எனினும், இலங்கையில் பயன்பாடு என்னும் பொருளில் இச் சொல் பரவலாகப் பயன்படுத்தப்படுகிறது. (பாவனையாளர், பாவனைப் பொருட்கள் இன்னும் பல).
- ↑ 1. C – H = 413kJmol-1 2. C – C = 340kJmol-1 3. C = C = 615kJmol-1
- ↑ ”கொழுப்புத் தன்மை” எனும் கருத்தில் பெயரிடப்பட்டது.
- ↑ ”இனிய மணமுடையன” எனும் கருத்தில் பெயரிடப்பட்டது.
